【建模文章解读】采用吸收与PBPK模型支持雷西纳德速释片剂的溶出与粒径标准的制定

导 读
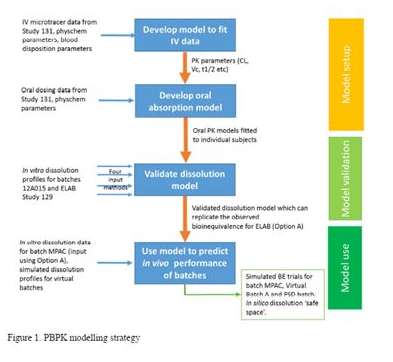
基于生理的药代动力学(PBPK)模型被广泛应用于制药行业来预测口服药物的吸收。由于能够预测分析多种因素,如API的性质、剂型及胃肠道环境等对口服药物吸收的影响,因此,PBPK模型作为一种有用的生物药剂学工具,能够整合体外测定的多种参数,如溶解度、渗透性、溶出行为来构建并评估药物的体内生物药剂学风险。目前,制药行业及监管部门均重视PBPK模型在药物研发及监管审评中的应用。本案例即为阿斯利康采用PBPK模型评估雷西纳德速释片体外溶出和粒度分布对药物体内行为的影响,并用于支持拟质量控制标准的建立。
原文献作者
Xavier J.H. Pepin,*,1 Talia R. Flanagan,1
DavidJ.Holt,1AnnaEidelman,2DonTreacy,2
Colin E. Rowlings2
1.英国阿斯利康,药学研发部
2.美国Ardea Biosciences,药学部
解读人
许尤新,凡默谷技术部
1 研究背景
本案例讲述了制药企业阿斯利康和Ardea公司在回顾雷西纳德(ZURAMPIC®)片剂上市后使用情况时,利用生物利用度试验研究中的体外和体内数据,采用GastroPlus软件建立了雷西纳德片的体内PK模型;并基于建立的模型评估体外溶出和粒度分布对体内行为的影响,用于支持雷西纳德片溶出标准和粒度分布标准的制定。此外,这部分工作已被FDA接受讨论建立雷西纳德速释片剂的质量控制策略。
雷西纳德(ZURAMPIC®)是一种选择性尿酸重吸收抑制剂,以口服速释片剂给药。雷西纳德最近被批准与一种黄嘌呤氧化酶抑制剂联合用药,用于治疗痛风相关的高尿酸血症。在回顾药品上市后使用情况期间,进行了一系列的PBPK建模与模拟工作并提交给了美国FDA,用以支持拟质控策略的建立,同时证明拟建立的溶出与粒径控制标准能够保证各批次产品合理的临床性能。
PBPK模拟策略:
雷西纳德分子量为404.3g.mol-1,为弱酸性化合物,Acid pKa为3.2,log P为2.85;该物质呈晶体状粉末,熔点为170℃。
2.1 溶解度
雷西纳德在胃中pH溶解度较低,在小肠中pH(5.3-7.5)溶解度高。

在GastroPlusTM中,FaSSIF和FeSSIF介质中的溶解度被用于拟合出溶解因子(SR),为5803;在模拟中基于胆酸盐的影响同时选择调整溶解度与扩散系数。
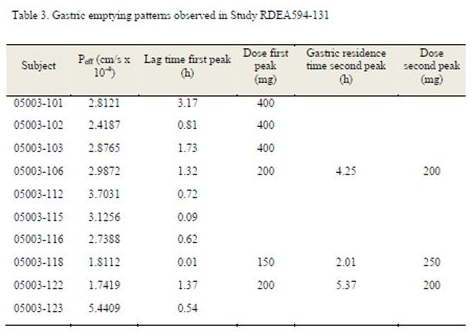
Caco-2细胞试验(A – B Papp)结果提示雷西纳德具有高渗透性;基于绝对生物利用度研究中的口服及静脉的PK数据,在GastroPlusTM中分别拟合了每个个体的空肠渗透系数Peff值,10个受试者所计算的平均空肠Peff值为3*10-4 cm/s( 变异范围为1.7-5.4*10-4 cm/s)
采用质控溶出方法测定了雷西纳德片的体外溶出:pH4.5醋酸盐缓冲液(含1%SLS),900mL,USP 2法,37℃,75rpm。除该方法外,同时也测定了雷西纳德片在普通水性缓冲液(pH3、4和5)中的溶出。
模拟中采用了12A015,ELAB和MPAC 3个批次的样品。其中12A015作为参比批次;ELAB批为造粒工艺超出商业操作范围的批次,其溶出较慢且释放不完全;MPAC批次样品相比于12A015批次溶出偏慢,但临床结果在可接受范围。
体外结合实验中,人血浆蛋白浓度水平为1和10μM时,结合率大于98%;血浆蛋白浓度为50μM时,结合率为97.9%。
全血/血浆药物浓度比,基于人体ADME研究(RDEA-594-112)确定,该值在0.55左右。
PK数据来自于两个关键的临床药理试验,RDEA-594-131(绝对生物利用度研究)和RDEA-594-129(相对生物利用度研究),用于建立和验证模型。
此外,采用了人体ADME试验研究(RDEA-594-112)的数据,用于模型的处置参数的设置。
在ACAT模型中,小肠和结肠部分水的体积分数由默认值(40%和10%),基于实测的数据,分别减少至7.5%和2%;(胃肠道中水的体积是控制药物生物利用度的关键因素)
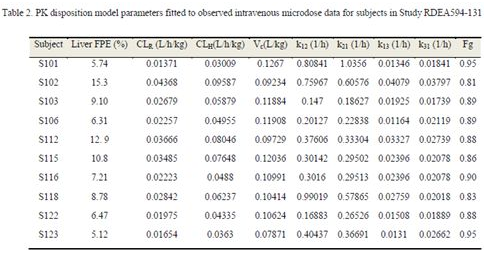
采用PKPlus,基于绝对生物利用度研究中10个受试者的IV数据,分别计算了每个个体的PK参数;人体ADME研究中,证明雷西纳德主要通过肾脏排泄,其中31.3% 是以原型形式被肾排泄。因此基于以下公式,由总清除(CLT)分别计算肝清除(CLH)和肾清除(CLR):
CLT=CLH+CLR; CLH=CLT*0.687; CLR=CLT*0.313
肝脏首过比例通过以下公式估算:
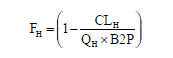
其中,CLH是肝清除率,QH是人肝脏血流(假设为常数90L/H),B2P是全血/血浆比。
同时基于该组10个受试者口服400mg雷西纳德片(12A015批)的PK数据,优化了个体的有效渗透参数和胃排空模型,并计算了肠道的首过比例。
10个受试者口服400mg片剂后的PK参数:
优化后的有效渗透性及胃排空模型:
虚拟生物等效性试验研究中,设置25例虚拟受试者,并主动设置了以下变量:
剂量变异系数为目标剂量的±3%;粒径形状因子变异系数为±10%;沉淀粒径变异系数为±10%;
胃中的pH和胃中转运时间的变异,按照以下Excel公式计算:
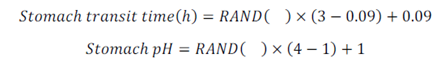
该公式允许胃转运时间在绝对生物利用度研究中观测的范围上进行变化,同时胃中pH的范围在1-4之间。
雷西纳德微量静脉滴注15min的PK数据分析,在体内的处置符合3房室模型,具体的PK参数见Table2。口服PK模型的模拟,是针对每一个受试者单独建立模型。
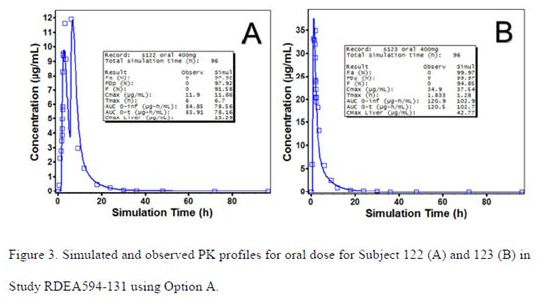
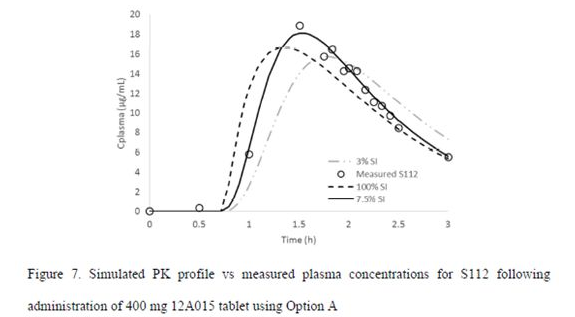
绝对生物利用度临床试验中,有些受试者口服400mg片剂后,体内表现出了多峰的现象,如下图:

雷西纳德为弱酸性药物,分析认为其胃中的不完全排空是造成双峰的主要原因;因此拟合这类个体的时候,采用了上述的lag time和胃排空模型。模型拟合结果如下:
通过以下4种方式将溶出数据整合至GastroPlus软件中:
采用体外溶出数据拟合每一批的粒度分布数据,作为GastroPlus中的Support File,剂型选择为DR: Tablet Ent Coat,胃滞留时间根据实测PK数据进行拟合;
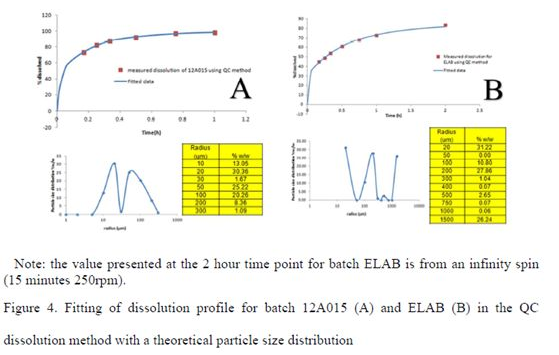
将QC方法下获得的溶出数据,同时考虑药物的溶解度,溶出体积和介质温度等,采用Microsoft Excel工具,通过计算可获得一组理论的粒度分布数据;该粒径数据可作为GastroPlus软件中直接输入的数据,用以在ACAT模型中计算体内的溶出。12A015和ELAB批计算得到的理论粒径数据见Figure 4。
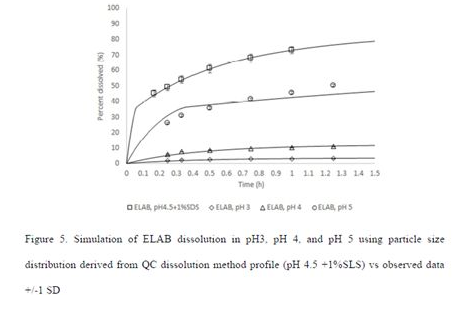
进一步验证了采用质控溶出方法下的溶出结果,拟合的粒径数据能否准确预测ELAB制剂在pH3、pH4和pH5介质中的溶出;上述介质中,表观溶解度分别采用0.016、0.053和0.385mg/mL。Figure5显示了基于计算的粒径能够较好的拟合其他介质中的溶出结果:
采用体外溶出数据拟合威布尔方程,剂型选择CR dissolved,同时设置lag time;
该方式下剂型设置为“controlled release dissllved”,采用单侧Weibull方程拟合12A015批制剂QC方法下的体外溶出,同时根据体内PK数据,针对每个受试者,Weibull方程中增加了lag time的参数,防止药物在胃中溶解;为了避免出现药物在肠道中沉淀的现象,每个受试者的模型中均将沉淀时间设置为100000s;此外,由于受试者106号、118号和122号出现多个吸收峰的现象,不参与此种方式的评估。
采用体外溶出数据拟合Z-Factor因子,剂型选择DR: Tablet Ent Coat,胃滞留时间根据实测PK数据进行拟合;
基于QC方法下测得的溶出曲线,以及体外溶出条件(体积、介质中溶解度和剂量),分别计算了12A015、ELAB和MPAC 3批制剂对应的Z-factor,结果见下图;
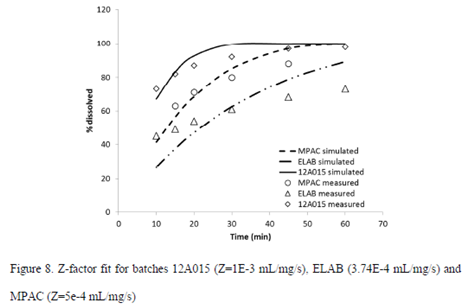
由于实测的体外溶出数据多是多相的曲线,而Z-factor模型是单相的,所以基于Z-factor的溶出速率并不能充分表征实测的溶出
采用体外溶出数据拟合威布尔方程,剂型选择CR Undissolved;并在威布尔方程中设置lag time来表征胃中滞留时间。此外,在拟合体内溶出速率时考虑各批次对应的粒度分布数据。
采用上述4种方式,对12A015和ELAB两批数据进行了模拟,考察是否能重现相对生物利用度研究中ELAB批Cmax和AUC偏低的现象。
绝对生物利用度研究Study RDEA594-131模型评估结果:
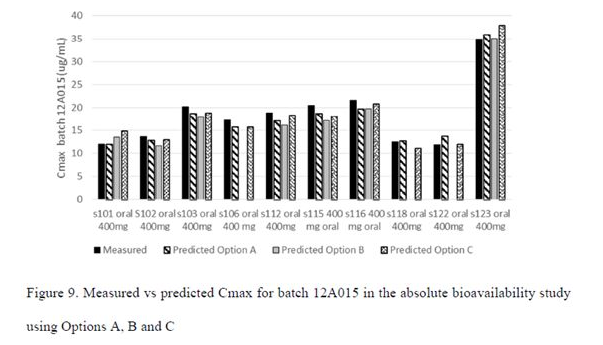
A、B、C 3种方法Cmax预测准确性比较结果
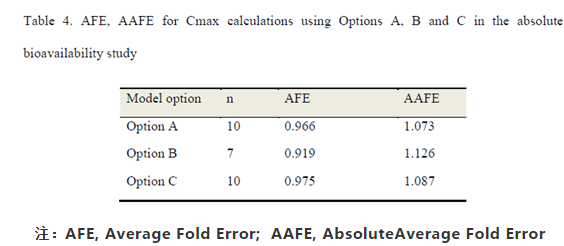
注:AFE, Average Fold Error; AAFE, AbsoluteAverage Fold Error
相对生物利用度研究RDEA-594-129模型评估结果:
绝对生物利用度研究中,采用参比12A015批制剂的体内PK与体外溶出数据,评估4种整合溶出数据至模型中的方法的合理性。从预测Cmax的结果来看(Figure 9),A、B、C 3种方法均能比较好的预测临床试验中的实测结果,其中A和C方法预测结果的AFE和AAFE值更接近于1(Table 4);采用B方法在各个受试者模型中预测的Cmax较测量结果要偏低。
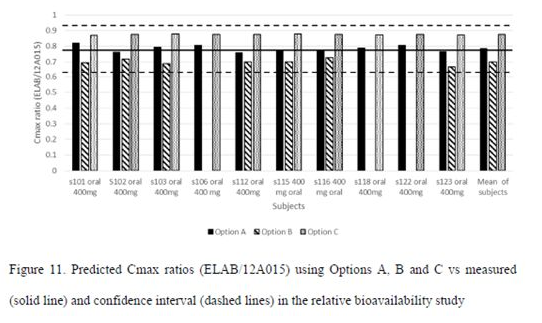
相对生物利用度研究中,进一步评估A、B、C 3种方法中,哪种方法能够更好的将ELAB与12A015两批制剂的体外溶出差异与体内吸收差异联系起来;该部分通过比较不同方法预测两批制剂的Cmax ratio ( ELAB/12A015 )的大小,如预测值接近于0.8 (临床试验中,ELAB批制剂体内暴露偏低),则认为所对应的方法更为合理。从预测结果(Figure 11)来看,A方法在各受试者模型中预测的Cmax ratio均接近于0.8,即Option A是将体外溶出数据整合至模型中的更合理的方法。
MPAC批和12E058批制剂体外溶出满足推荐的溶出标准,但接近其溶出限度(30min, 80%),且MPAC批制剂溶出相对更慢一些,因此采用MPAC批制剂进行虚拟BE模拟,考察接近溶出限度时是否仍能和12A015批生物等效;
同时虚拟了一个具有更低溶出的批次A(低于溶出限度,但高于ELAB批溶出,2h左右溶出完全),考察其是否仍能够通过虚拟BE。
根据两个批次的体外溶出数据拟合出的理论粒径分布数据如下:
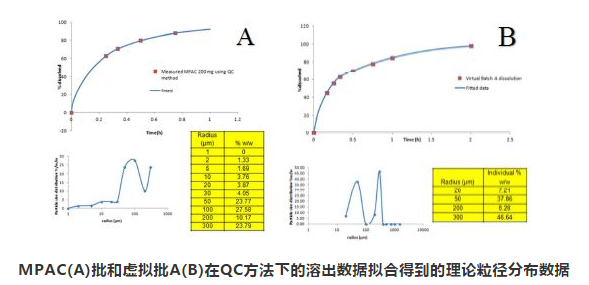
MPAC(A)批和虚拟批A(B)在QC方法下的溶出数据拟合得到的理论粒径分布数据
采用25例虚拟受试者,按照双交叉设计模拟MPAC、ELAB批制剂与12A015批参比制剂的生物等效性,统计结果见Table 5;
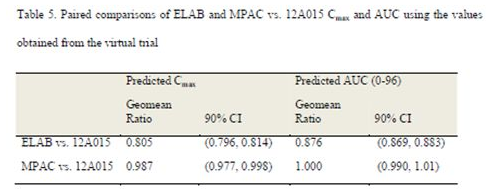
模拟结果显示,MPAC批与预期的结果一样,能够和12A015批生物等效,AUC和Cmax的几何均值比值均接近于1;ELAB批制剂如前所述,由于其溶出速率远低于推荐溶出标准,且溶出不完全,临床试验中暴露较低,与 12A015批生物不等效。虚拟BE的结果同样显示Cmax偏低,且90%CI不能满足BE的接受标准(90%CI在0.8-1.25内)。
虚拟批次A与12A015批虚拟生物等效性模拟结果见Table 6。
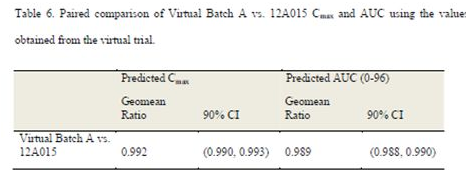
如某个批次制剂的溶出能够满足Cmax相比于12A015批的比值大概在1-0.9之间,则认为该批次制剂完全有可能通过正式的生物等效性试验研究。虚拟BE试验结果表明,虚拟批A与12A015批生物等效,且Cmax和AUC的几何均值的比值均接近于1。
基于以上模拟结果,能够满足临床与参比12A015批生物等效的体外溶出空间见图14,其中阴影部分为推荐的溶出空间。
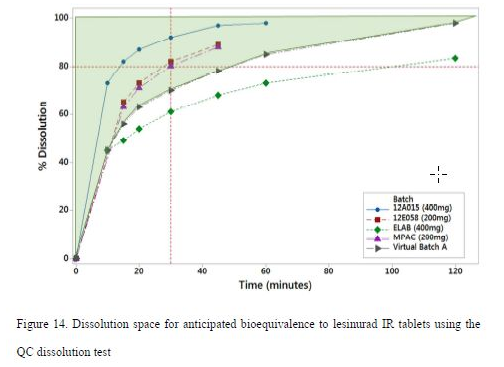
拟推荐的最大粒度分布标准如下:
D(v, 0.5) NMT 70μm; D(v, 0.9) NMT 159μm
12A015批参比制剂采用的API的粒度分布数据为D(v, 0.5) 23.2; D(v, 0.9) 45.9,虚拟批次VDS1采用上述最大的粒度分布数据;
采用上述绝对生物利用度研究的10个受试者的模型,分别预测虚拟批VDS1和12A015批在体内的生物等效性。12A015批粒度分布数据采用log normal分布,平均粒径为11.5μm,SD为3;虚拟批VDS1粒度分布数据采用log normal分布,平均粒径为35μm,SD为10。
模拟结果显示,在任一受试者模型中,虚拟批VDS1预测的Cmax, Tmax和AUC,与12A015批预测结果相比,均未观测到明显差异,二者均能生物等效。
模型设置中考虑了肠腔中的液体体积对雷西纳德体内暴露的影响,采用112号受试者模型,评估了3%、7.5%和100%的小肠中水的体积对药物吸收的影响;十二指肠中水的体积可以通过影响药物溶解的量进而影响吸收,但空肠中不存在此现象。
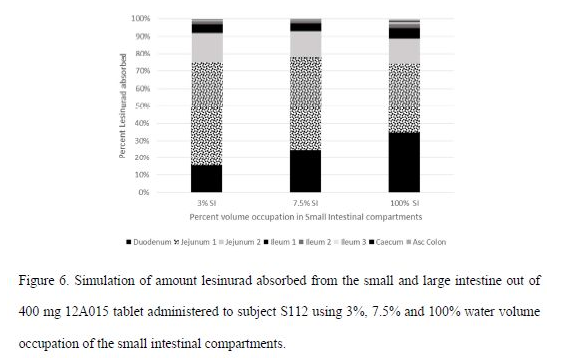
根据PK模拟的结果,最终选择肠道水的体积为7.5%。
评估4种整合体外溶出数据至模型中的合理性过程中,Option D方法与Option B方法类似,且Option D方法中,制剂释放的是未溶解的颗粒,相比于Option B,会导致药物在胃肠道中有更低的吸收。鉴于Option B所预测的Cmax Ratio值已经偏低,故认为Option D同样不是能够合理预测雷西纳德制剂在胃肠中吸收速率的方法,故未进行进一步的模拟。
为进一步探索采用Option A对ELAB批有更好的模拟结果,在A方法下,采用更大的粒度分布数据进行了PSA分析。在能够表征ELAB批的粒度分布范围内,溶解度与粒径(即溶出速率)对Cmax的影响与体内渗透的影响相当。该结果也表明为何所有的模型均能够比较好的模拟比如12A015批的Cmax,但在模拟溶出较差的批次如ELAB批时,并不是所有的模型均能给出比较好的模拟结果,因为这类预测更依赖于是否能很好的模拟溶出速率。
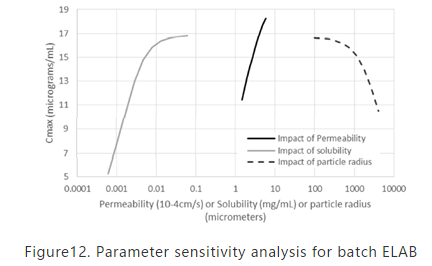
Figure12. Parameter sensitivity analysis for batch ELAB
该案例采用GastroPlus软件建立了针对每一个临床受试者的口服吸收预测模型,并采用建立的模型,验证了4种体外溶出数据的输入方式,评估哪种溶出数据输入方式能够重现ELAB批次生物不等效的结果;最后采用验证后的Option A方法,预测了各批次的体内生物等效性;并进一步通过虚拟批次,探讨了能够保证体内生物等效的溶出空间及粒度标准,为拟建立的溶出与粒度控制标准提供了支持。
该案例应用的软件是GastroPlus (version 9.0),涉及模块有Base, IVIVC, Optimization, ADMET Predictor.
Pepin XJ, Flanagan TR, Holt DJ et al. Justification of Drug Product Dissolution Rate and Drug Substance Particle Size Specifications Based on Absorption PBPK Modeling for Lesinurad Immediate Release Tablets. Mol Pharm. 2016 Sep 6;13(9):3256-69. IF=4.342


