【建模文章解读】联合PBPK模型和PopPK模型预测缬更昔洛韦儿童给药剂量,并指导注册申请
推荐理由
新药研发具有高投入高风险的特性,其中临床试验更是艰巨且漫长的任务,包括探索合理的临床给药剂量,从而保障临床给药后的安全性和有效性。而在儿童临床试验中,由于伦理、受试者招募等限制,更是难中之难。
本案例结合已经开展的成人及儿童临床试验结果,综合应用生理药代动力学PBPK模型和群体药代动力学PopPK模型,评估更昔洛韦及前药缬更昔洛韦在年龄4个月以内器官移植婴儿患者体内的给药剂量方案,以支持这两个药品的临床注册申请,与法规部门的交流沟通。
原文献作者
文章1:V. Lukacova,1 P.Goelzer,2 M. Reddy,3 G. Greig,4 B. Reigner,4and N. Parrott5
1. 美国Simulations Plus, Inc.
2. 美国梯瓦制药公司
3. 美国Array生物制药公司
4. 瑞士罗氏临床药理部门
5.瑞士罗氏制药科学部门
文章2:K Jorga1, C Chavanne2,N Frey2, T Lave3, V Lukacova4, N Parrott3,R Peck2 and B Reigner2
1.瑞士KarinJorga生命科学咨询公司
2.瑞士罗氏,临床药理部
3.瑞士罗氏,制剂科学部
4.美国Simulations Plus公司
解读人
陈涛,凡默谷技术部
文献摘要
更昔洛韦及其前药缬更昔洛韦可用于预防及治疗免疫功能缺陷病人的巨细胞病毒感染,如艾滋病患者,接受化疗的肿瘤患者,使用免疫抑制剂的器官移植病人等。
本研究结合已经获取的临床研究PK数据,通过建模与模拟的手段(包括生理药代动力学PBPK建模)整合相关信息,以回复药品监管部门的相关问题,同时指导药物在年龄4个月以内器官移植儿童的给药剂量估算。
1 研究背景
更昔洛韦及其前药缬更昔洛韦已经开展了临床前动物、成人以及儿童的PK实验,并建立了给药剂量估算的公式;然而,在所建立的剂量估算公式中,未将年龄小于4个月的器官移植患者考虑进去。后续又进一步补充了少数患者(17个人)的临床试验,由于患者数量较少、且补充个数较为困难。因此该研究基于建模与模拟的方式充分利用现有的数据,并进行适当的预测推导,以综合回复药品监管部门的相关问题,包括给药剂量推算的注册申请;
文章采用群体药代动力学模型(PopPK)和生理药代动力学模型(PBPK)对药物给药剂量估算做综合分析和预测。这两种方法都较常用于支持儿科给药的开发研究,但彼此均由一定的优缺点。PBPK整合药物相关参数以及生理解剖相关的参数以预测不同人群的PK曲线,一般称为自底向上的方法;而PopPK则是数据驱动的房室模型,通过整合统计学、变量等元素描述剂量和药物浓度之间的关系,一般为自顶向下的方式;
外推至新生儿PBPK模型发现与稍大儿童相比,潜在的生理学差异对体内PK的影响不是很明显;联合体表面积和肾功能等因素构建的PopPK用于模拟更昔洛韦在儿童体内的暴露,以及评估两种剂量估算方法的有效性。PBPK和PopPK模型共同确认现用的缬更昔洛韦的剂量估算方法可以使得不同年龄段儿童体内达到相似的更昔洛韦暴露,而替代的剂量估算方法将导致很大部分患者体内药物暴露较低;
研究通过联合PBPK和PopPK模型提高准确估算年龄小于4个月儿童给药剂量的信心,以支持该药物的注册审批。
2 建模数据与处理
2.1 药物相关的理化和生物药剂学参数

2.2 代谢酶与转运体数据
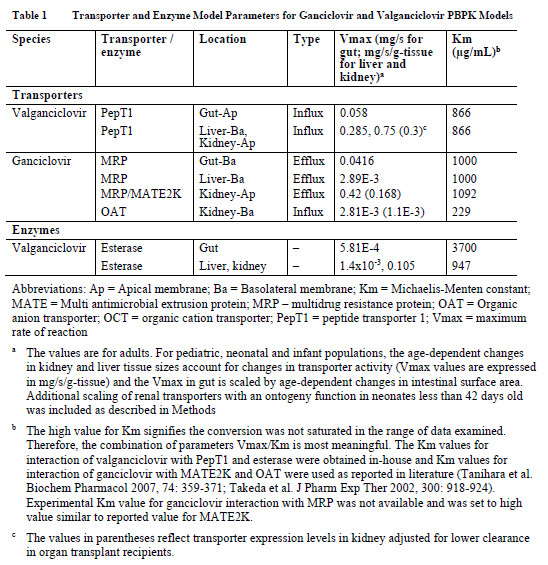
2.3 临床PK试验
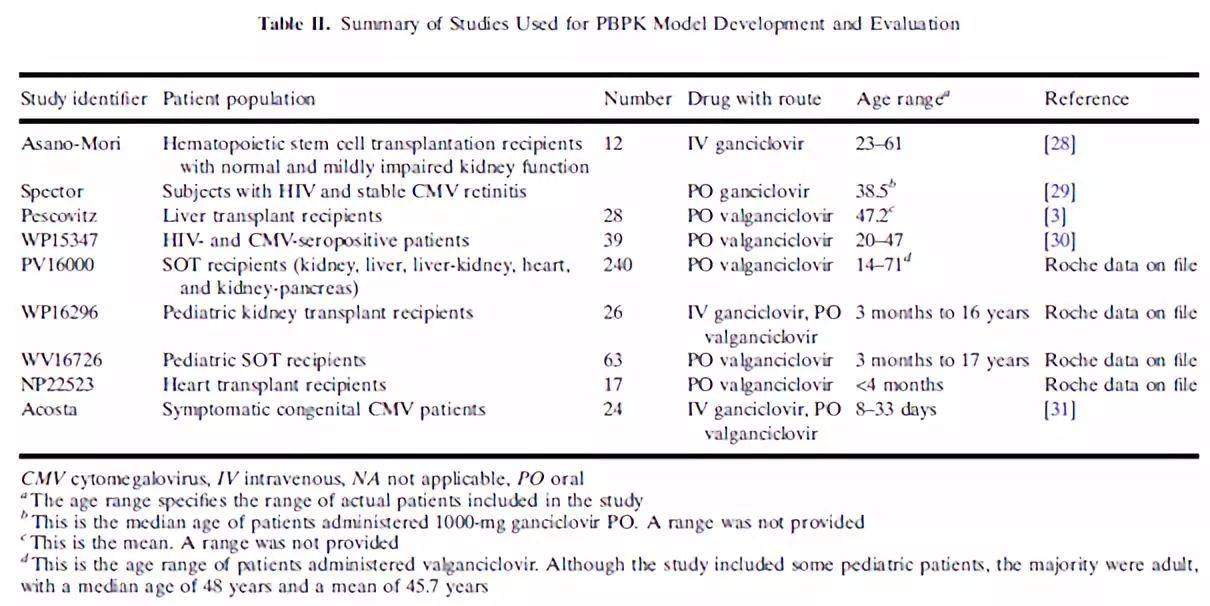
2.4 数据获取及处理
缬更昔洛韦的胃肠道降解处理,将体外测定的不同pH条件下的稳定性数据输入到软件中,进行自动处理和表达;
用细胞膜通透能力与表面积乘积(PStc)表征药物进入每个组织细胞的能力,为了减少参数优化的个数,模型通过优化确定得到单位体积细胞的PStc (Specific PStc)数值,再基于每个组织的细胞体积放大到每个组织器官。最终确定临床前所有动物的specific PStc为0.00031 mL/s/mL-cell volume,而人的该数值是0.0002 mL/s/mL-cell volume;
转运体或酯酶的动力学参数Km与Vamx在不同种属、不同亚型中表现有较大的差异,其中Km的数值通过来自实验测定或者文献报道的数据,Vmax数值则是通过血药浓度数据进行优化得到的;
部分转运体在当前软件模型中没有设置其表达水平的数据,因此通过查找文献的数据,并将其数据定义到相应的组织位置,以表达出每毫克组织器官或者每平方厘米肠道表面含有的转运体或代谢酶的数值;
采用mixed multiple dose的功能,表达不同的给药剂量、不同的给药途径或者不规则的给药间隔等复杂的给药方案;同时也选择不同的生理学模型,以表达多天的临床研究中儿童肾小球滤过率的变化、移植病人生理学参数的不断改变等情况;
PEAR功能产生的为一个年龄平均的人群信息,但由于新生儿、婴幼儿生理学差异较大、且各种疾病因素的影响导致该年龄段人群PK数据变异较大。因此在PEAR产生相应年龄的PBPK模型基础上,又进一步自定义了来自临床监测的个体数据,如肌酐清除率、体重等,以预测每个个体的PK曲线,并临床测定的个体PK数据点进行准确性比较。
3 模型结果与分析
3.1 动物PBPK模型的搭建与验证
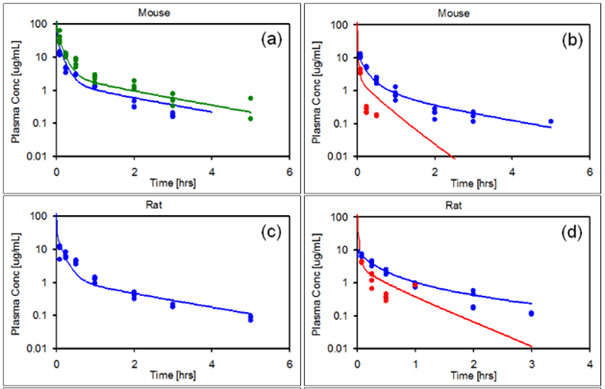
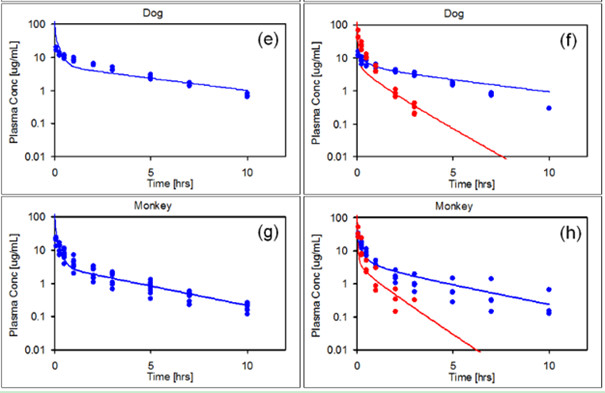
3.2 更昔洛韦成人PBPK模型
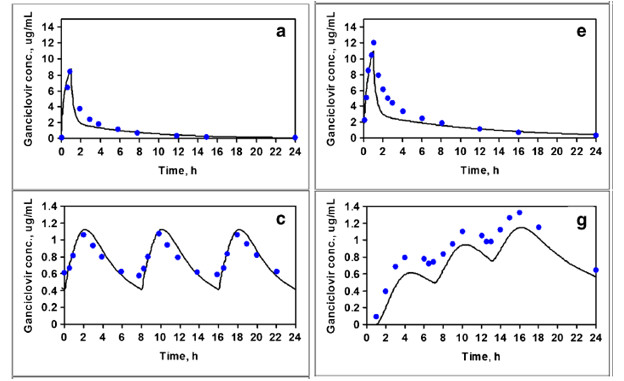
更昔洛韦不同给药方案后血浆药时曲线的实测平均值(点)和预测曲线(线):图a为5 mg/kg更昔洛韦在平均38岁HIV病人静脉推注1小时给药后的药时曲线;图c为平均38岁HIV病人在每天三次口服1000 mg更昔洛韦后第14天的药时曲线;图e为28位平均47岁肝脏移植病人静脉给药5 mg一天后的药时曲线;图g为平均47岁肝脏移植病人每6小时口服给药1000 mg更昔洛韦后第1天的药时曲线。
基于已经搭建的动物模型及其相关的提示,在人体PBPK模型中,增加了MRP4和OAT1转运体的数据以考虑转运体介导额主动分泌;此外还考虑了转运体MATE1分泌药物到胆汁中的作用;
为了匹配药时曲线的形状以及非房室模型计算得到的Vss数值,人体模型中调整了specific PStc数值至0.0002 mL/s/mL-cell volume;
更昔洛韦在器官移植病人体内的清除率要低于健康人群或HIV病人,因此对器官移植病人的模型降低了60%的肾脏转运体的水平(0.75 vs. 0.3 mg/s/g-tissue for Vmax)。
3.3 缬更昔洛韦成人PBPK模型
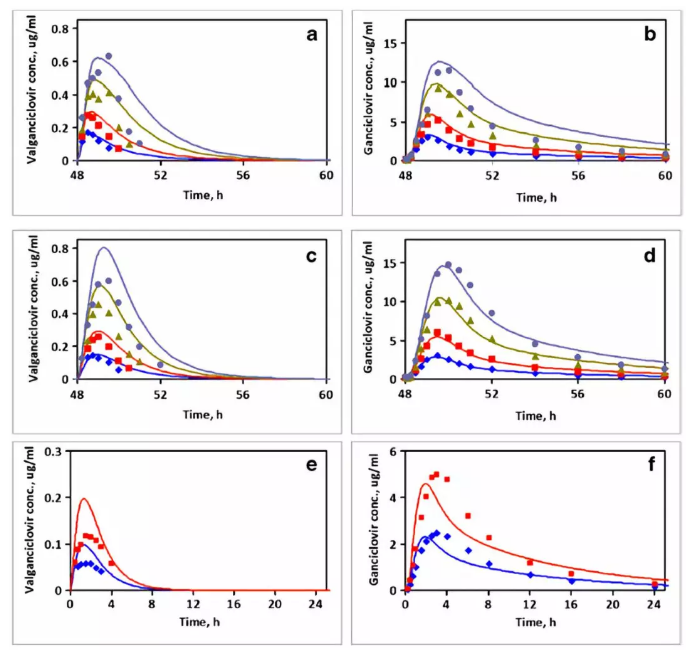
口服不同剂量的缬更昔洛韦后模拟的缬更昔洛韦及更昔洛韦药时曲线(线)和实测值(点):图a和c为HIV和CMV病人空腹和饱腹状态下每天口服450 mg (蓝色),875 mg (红色),1750 mg (绿色),2625 mg (紫色)缬更昔洛韦后第3天缬更昔洛韦的药时曲线;图b和d为对应条件下更昔洛韦的药时曲线;图e是肝脏移植病人单次给药450 mg (蓝色)和900 mg (红色) 缬更昔洛韦后的药时曲线;图f为对应条件下更昔洛韦的药时曲线。
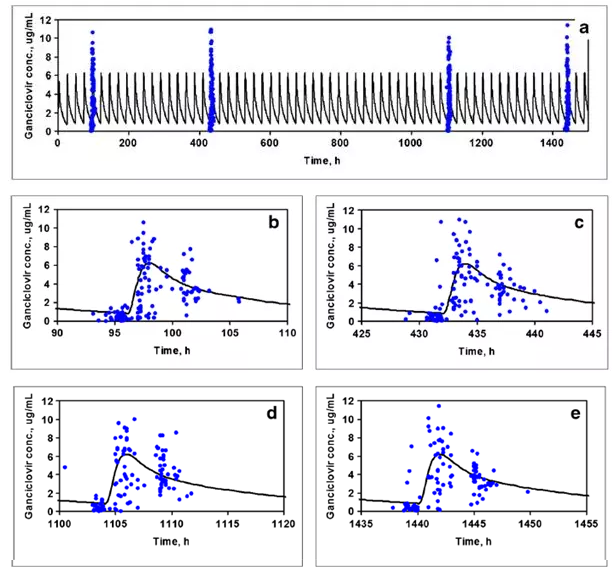
3.4 儿童PBPK模型
每天口服900 mg缬更昔洛韦在不同的四天实测(点)和模拟(线)的更昔洛韦血浆药时曲线:图a是完整周期的药时曲线,图b-e是每个周期的药时曲线。实测数据来自成人器官移植后临床试验测定的稀疏取样点。
模型中缬更昔洛韦到更昔洛韦的生物转化除了考虑基于酯酶代谢的作用,还考虑了PepT1的主动转运作用;且使用了动物相同的specific PStc数值考察缬更昔洛韦的跨膜转运过程;
图e模拟结果显示有一定的高估,主要原因是临床实测数据显示在两个相似剂量下却表现有两倍左右的血药浓度差别,可能两个临床研究采用的不同患者的疾病因素导致了较大的PK个体差异;
模拟结果显示,缬更昔洛韦到更昔洛韦的生物转化主要是由肝脏酶的代谢作用,肾脏排泄的作用几乎可以忽略不计。在代谢转化中,98%以上的部分是发生在肝脏中,小于1%的部分发生在肾脏和胃肠道中。因此肝脏的高代谢,也导致了缬更昔洛韦的低生物利用度(8%左右)。
3.4 儿童PBPK模型
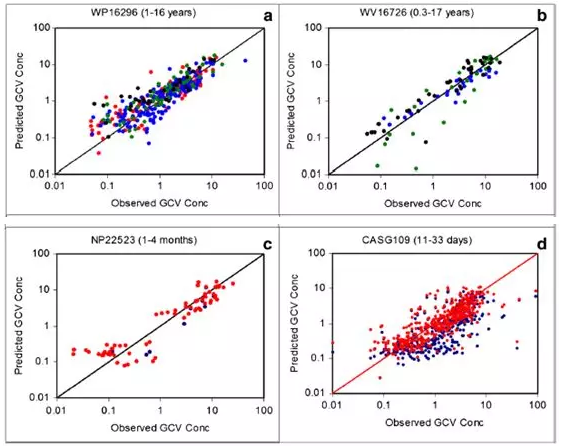
不同儿童人群静脉更昔洛韦和口服缬更昔洛韦后模拟与实测的更昔洛韦血药浓度:图a为WP16296的临床试验,为年龄1到16岁肾移植患者的PK数据;图b 为WV16726的临床试验,为年龄3个月到17岁心脏移植患者的PK数据;图c 为NP22523的临床试验,为年龄1到4个月心脏移植患者的PK数据;图d是来自Acosta的1个月以内新生儿PK研究数据。每个图均用了不同的颜色区分出更具体的年龄段:图a-黑色 (1 到3岁),绿色(5到8岁),红色(9 到12岁),蓝色(13到16岁);图b-黑色(0.3到2岁),绿色(4到6岁),蓝色(15到17岁);图c和d分别用蓝色和红色表示新生儿肾脏转运体表达水平采用成人的数据以及调整后的数据。
生理学参数按照临床报道的每个个体的年龄、体重、肾小球滤过率等参数并结合PEAR模型产生,移植患者的肾脏转运体水平按照成人模型一样降低了60%,然后进行模拟每一个个体的PK曲线,并与其临床数据进行比对(结果该案例解读未展现,可阅读原文了解更多信息);
根据每个个体的胎龄、日龄、性别、体重等参数建立和预测的新生儿PK结果,基本与实测值较为吻合,虽然结果有稍微的低估。目标人群表现与其他人群相似的暴露-反应行为,且PBPK模型未发现有其它的生理机制会影响其体内的暴露;按照当前的剂量估算方法,新生儿给药后在体内有较为合适的暴露,因此PBPK模型结果表明对于器官移植的新生儿患者不太需要调整剂量估算方式。
3.5 模型的应用
3.5.1 PBPK和PopPK联合应用的基本思路
在利用现有报道或开展的临床PK数据、体外测定或者文献报道额理化、生物药剂学、代谢酶与转运体的数据,成功搭建了更昔洛韦以及前药缬更昔洛韦在动物、成人、儿童、新生儿等PBPK模型。通过PEAR功能和临床监测的数据,构建了目标研究人群(年龄小于4个月器官移植的新生儿)的体内生理学模型,并成功、准确地预测了每个个体的PK曲线。PBPK模型研究结果表明,在当前给药剂量方案下,模型可以很好地反映临床实测结果,且目标人群与其他人群具有相似的暴露-反应特点,没有发现更多的生理机制会影响该群体体内的暴露,因此该群体可以沿用现有的剂量估算方案。
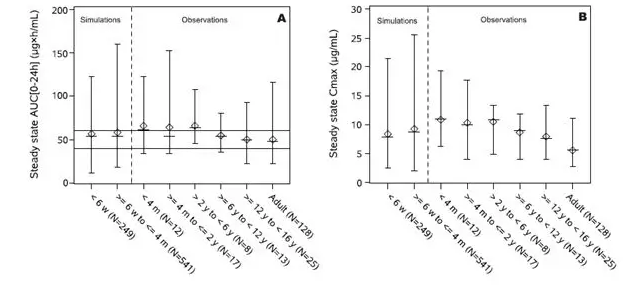
结合临床有效性的研究,更昔洛韦给药后在体内24小时的目标暴露需达到AUC0-24在40-60 μg.h/mL范围,才能更好地起到治疗效果。因此研究在PBPK模型的基础上,又进一步联合了PopPK模型,共同对目标人群剂量估算方案的确证。PBPK和PopPK两大模型在本研究中的应用思路为:
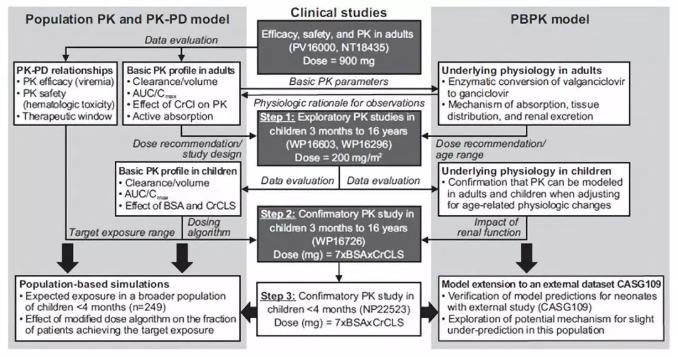
联合采用PBPK和PopPK模型,并使用来自已经开展的成人、儿童、婴幼儿、新生儿等PK数据,不断学习、确证缬更昔洛韦和更昔洛韦在目标儿童人群给药剂量估算的流程。
给药方案:儿童患者的剂量估算的方案先前已经根据更昔洛韦体内暴露量建立起来了。缬更昔洛韦主要通过肾脏分泌消除,采用Schwartz方法计算得到肌酐清除率并用于剂量的估算,同时根据Mosteller方程计算患者体表面积,得到如下的估算方法:
4 模型讨论
药物分布特点-缬更昔洛韦和更昔洛韦都是亲水性的药物,且透过细胞膜的被动扩散能力很弱,同时结合静脉给药后的Vss数值,确定采用膜限速组织可以较为准确地表征药物从血液室进入到细胞内的过程。并采用Specific PStc数值放大计算每个组织渗透性与细胞表面积的乘积,该数值是基于动物以及成人PK结果优化反推得到;
转运体的作用是该药物体内过程的另一重要因素,更昔洛韦是外排转运体MRP4的底物;此外分布在肝脏和肾脏中的MATE1和MATE2-K转运体也作用于更昔洛韦;摄取转运体OAT1还会携带该药物进行细胞内。缬更昔洛韦则受到摄取转运体PepT1的作用。所有这些转运体的相关数据(分布、动力学数据Km和Vmax等)有来自文献报道的数值,也有通过PK数据进行优化得到的;
前药PBPK模型的处理及清除率的表征:缬更昔洛韦主要通过存在于胃肠道、肝脏、肾脏中的酯酶代谢转化为更昔洛韦,其中肝脏的贡献大于98%以上,且每摩尔前药代谢转化为1摩尔的更昔洛韦;缬更昔洛韦在吸收过程,还另外受PepT1转运体的作用;在消除过程,还有部分肾脏清除的作用;
病人PBPK模型的相关考虑:病人的PBPK模型基于PEAR功能自动产生,并将部分临床监测的数据如肌酐清除率、体重等输入模型进行替换。普通的病人如HIV等PBPK模型参数,基本采用健康人的生理学参数和模型结构;而器官移植的病人,模型中通过降低60%肾脏转运体的表达水平,进而减小了药物的清除率;另外在年龄很小的婴幼儿体内,其部分转运体的表达水平要比稍大儿童或成人的数值变小,模型中也尝试降低其表达量得到拟合误差更小的PK曲线预测结果;
PBPK和PopPK模型在案例中的联合应用:案例通过PBPK模型的自底向上的方法,结合药物理化、生物药剂学、代谢、转运体、生理学等参数构建模型,重现了不同年龄段、不同疾病状态下的临床PK研究结果。通过PBPK模型的搭建表明在目标人群 (年龄小于4个月器官移植的新生儿)体内,按照当前的剂量方案,模型可以很好地重现每个个体的临床结果。生理学模型结果未发现更多的机制会影响该群体的体内暴露,因此当前的剂量估算方案可以用于这一特殊人群;群体药代动力学模型PopPK从自顶向下的方式,结合临床PK数据、临床个体的生理学参数构建模型,并合理推广该模型到更多临床个体人群,结果表明当前的剂量方案与替代的剂量方案相比,虽然落在目标暴露水平(40-60 μg.h/m)的均值都在43%左右;但对于低于暴露水平下限(<40μg.h/m)的情况,当前剂量方案的比例更小,对于所研究的目标人群也可以采用当前的剂量方案。综合PBPK和PopPK模型,结果共同支持对于所研究的目标人群,可以采用Dose (mg)=7×BSA×CrCls的剂量方案;同时也对验证和拓展了NP22523的临床研究结果,共同支持该药物的注册申请,以及与监管部门的交流沟通;
当纳入到数据集里面的疾病人群不足以完全代表所有患者情况,可能会导致所模拟的数据超过预测的范围,进而导致预测结果的不确定性,这也成为PopPK模型的一个应用缺陷。在这方面,又恰好是PBPK模型的一个长处,可以基于已知不同生理学特征的人群以及合理的假设,桥接到其它疾病人群,并进行合理、准确的预测。该研究中,即是使用稍大儿童的生理学模型,桥接到新生儿更昔洛韦的PBPK模型,通过优化新生儿肾脏转运体的表达使得预测结果较为合理,同时也发现该潜在的生理学差异对药物的体内暴露影响较小。
5总结
该案例分别采用了PBPK和PopPK模型研究了缬更昔洛韦和更昔洛韦的临床PK研究结果-PBPK模型建立了药物在不同人群体内的PK模型,通过自底向上的方向成功预测了药物人群体内的ADME过程,通过机制性的研究,未发现更多的机制将影响目标人群的体内PK行为;PopPK模型利用开展的临床PK数据和人群信息,综合这些稀疏数据构建群体PK模型,并预测更多虚拟人群给药后的PK行为,结果表明若降低目标人群的剂量,会导致低于目标暴露水平的比例增大。联合PBPK和PopPK模型,发现对于目标人群的临床给药剂量可采用Dose (mg)=7×BSA×CrCls这一现有的估算方案。两个模型的结果相互支持、共同确定,以用于支持这两个药物的临床注册申请和剂量确证。
6 应用软件与模拟
该案例PBPK模型应用的软件为GastroPlus (version 9.0),涉及模块有Base, PBPK, Metabolism & Transporter, Optimization, ADMET Predictor, PKPlus。
7.参考文献
K Jorga, et al., Bottom-up Meets Top-down: Complementary Physiologically Based Pharmacokinetic and Population Pharmacokinetic Modeling for Regulatory Approval of a Dosing Algorithm of Valganciclovir in Very Young Children. Clin Pharmacol Ther. 2016 Dec; 100 (6): 761-769. IF: 6.544
V. Lukacova, et al., A Physiologically Based Pharmacokinetic Model for Ganciclovir and Its Prodrug Valganciclovir in Adults and Children. AAPS J. 2016 Nov; 18 (6): 1453-1463. IF: 3.804


