【建模文章解读】使用生理药代动力学模型联合药效模型(PBPK-PD)预测替格瑞洛及其活性代谢产物在肝硬化人群中的PK和PD
参考文献作者及单位
替格瑞洛用于减少急性冠脉综合征(ACS)患者的临床血栓事件,而又不增加大出血的风险。欧盟和美国心脏病学会已推荐该药物为ACS的一线治疗药物。
单剂量给药后,替格瑞洛会迅速吸收并在1.3至2 h达到峰值血浆浓度。替格瑞洛主要经CYP3A4酶代谢,代谢贡献率为95%,并生成活性代谢物(AM)和非活性代谢物。CYP3A5在替格瑞洛的代谢中为次要作用。替格瑞洛和AM均主要经粪便排泄,肾脏清除率较小。AM在血液中的浓度约为替格瑞洛的30%-40%,并且具有相似的抗血小板活性。用于P2Y12受体拮抗剂的一般药效学参数是抑制ADP刺激的血小板聚集(IPA),因此我们使用IPA作为替格瑞洛的抗凝功效的药效指标。
肝硬化是一种进行性疾病,使用Childe-Pugh(CP) A,B和C类进行分类,以定义疾病严重程度。肝硬化可导致生理状况发生变化,从而影响药物的药代动力学(PK)。基于替格瑞洛的代谢途径,肝硬化可能会改变替格瑞洛和AM的暴露并引起药效(PD)的改变,而实际用药过程中又可能出现肝硬化患者需要服用替格瑞洛的情况。因此,为了促进替格瑞洛的临床应用,已经进行了肝硬化人群的临床研究,Butler等报道了替格瑞洛在A级(CP-A)肝硬化人群的PK和PD研究,这也是唯一报道的临床研究。迄今为止,尚无CP-B和CP-C级肝硬化人群中替格瑞洛的PK和PD的相关报道。因此,有必要开发一种准确的方法来揭示替格瑞洛在CP-B和CP-C级肝硬化人群中PK和PD的变化。
本研究建立并验证了替格瑞洛PBPK模型,该模型可以用于预测不同人群静脉和口服药物后替格瑞洛和AM的PK,并将替格瑞洛PD模型与PBPK模型相结合,揭示了IPA的变化。还预测并验证了CP-A级肝硬化人群中替格瑞洛的PK和PD,并对CP-B和CP-C级肝硬化人群进行了预测。
2.1 替格瑞洛及其AM的PBPK建模数据与处理
替格瑞洛PBPK模型建模软件为GastroPlus™ v.9.6,替格瑞洛和AM物理化学与生物药剂学参数见Table 2,部分参数使用了ADMET Predictor软件的预测值。对替格瑞洛的原药粒径及其体外溶出行为的研究表明,替格瑞洛的原药粒径应控制在r < 10 μm,最终选择9 μm用于模拟PK曲线;Caco-2渗透性( 0.6*10-5cm / s )为实测值;基于实测的PK数据,将ADMET Predictor软件预测的替格瑞洛LogP = 3.52,调整为与AM一致,即3.58,fup优化为0.65%(文献值为0.6%)。替格瑞洛的溶解度( 0.063 mg/mL)为文献值。
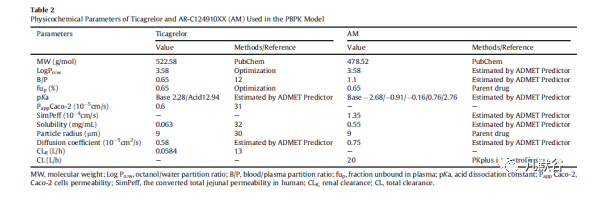
胃肠道模型为高级隔室吸收与转运模型(ACAT),将CYP3A4设为肝脏和肠道代谢的唯一酶,采用软件內建的年龄相关(PEAR)生理学模型进行人口生理参数估算。组织-血浆分配系数(Kp)采用Lukacova (Roders-Single)的方法计算得到。重组酶的酶促动力学参数Km和Vmax数据是从已发表的文献中获得。替格瑞洛被CYP3A4代谢为AM和AR-C133913XX的酶促动力学参数如下表(Table 3)。Vmax的系统间外推因子设置为1.2,该值是通过实测PK数据优化获得。
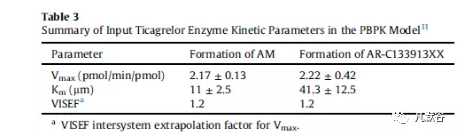
CYP酶未结合固有清除率(CLint,u)和全身血浆清除率(CLpb)的计算方法如公式1和2所示。在该模型中,肾脏排泄的作用少于清除率的1%。根据观测到的静脉和口服数据确定了AM的体内总清除率(CL)。
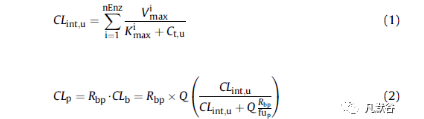
其中,CLint,u =未结合的固有清除率;K imax=酶i的米氏常数(在1/2Vmax处的底物浓度);V imax=酶i的最大代谢速率;Ct,u =组织中未结合的药物浓度;CLp,CLb =血浆和血液清除率;Rbp =血液/血浆浓度比;Q =组织血流量;fup =血浆中游离药物分数。
2.2 不同类型肝硬化人群的生理变化
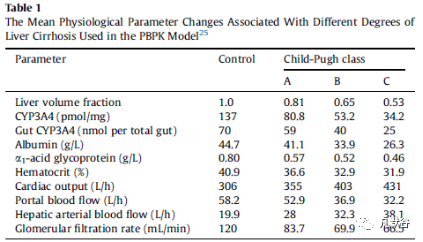
肝硬化会改变生理参数,包括血流量、心脏指数、血浆蛋白浓度、血细胞比容、肝功能量、肾功能和肝酶活性等。不同水平的肝硬化改变的生理参数见Table 1,健康人群的基线值作为补充数据(Supplementary Table S1)。
2.3 替格瑞洛及其AM的PBPK/PD模型建模数据与处理
替格瑞洛及其AM的PBPK模型与PD模型链接的建模流程如下图:
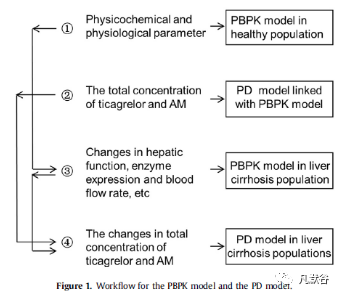
该流程涉及替格瑞洛及其AM的PBPK模型的建立、验证和预测过程,并将该模型与其PD模型相结合,所有模型的预测准确性均根据观察值和预测值之间的折叠误差(预测值/观察值)进行评估。在此策略中,第一步是建立健康成年人的PBPK模型;其次,将PD模型与已搭建的PBPK模型链接在一起;第三,建立并验证CP-A级肝硬化人群的PBPK模型,建立了其他不同肝硬化程度人群的PBPK模型。最后,将建立的其他不同肝硬化程度人群的PBPK模型与PD模型相结合,以预测其他肝硬化人群中的药效变化。
替格瑞洛PD模型选择IPA作为药效指示,采用GastroPlus 软件PD模块拟合PD数据,结果表明Sigmoid Emax模型(如公式 3所示)拟合PD效应最优,这也与文献中报道的一致,该模型的参数通过软件计算得到,并将该模型用于预测替格瑞洛血浆浓度曲线和PD 效应曲线。

其中,E=抑制血小板凝集作用的百分比;E0=基线效应;C=替格瑞洛和AM的总浓度,ng /mL;Emax=最大PD效应;EC50=最大Emax一半时的总浓度,ng /mL;γ= Hill系数,用于描述浓度-效应关系的斜率。
3. 结果与分析
3.1 健康人群PBPK模型的建立与验证
静脉注射替格瑞洛15mg PBPK模型的建立与验证结果(Figure 2):
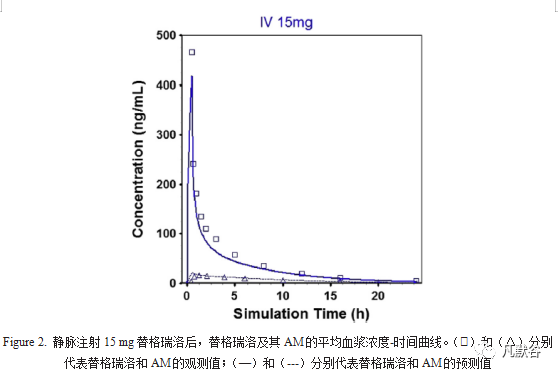
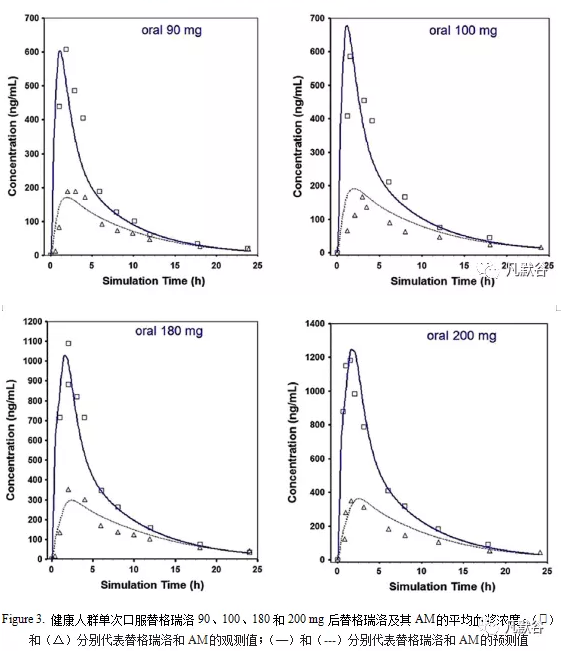
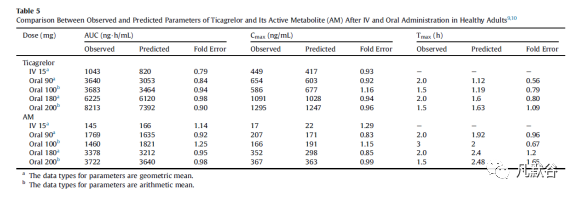
统计分析表明,AUC和Cmax的折叠误差基本上都在1.2的范围内,并且所有折叠误差均在2的范围内。口服不同剂量的替格瑞洛后,药物吸收迅速,预测Tmax为1至2 h,而AM的Tmax为2至3 h,与替格瑞洛相比稍有延迟,这也与实测结果一致。
3.2 健康人群PBPK/PD模型的建立与验证
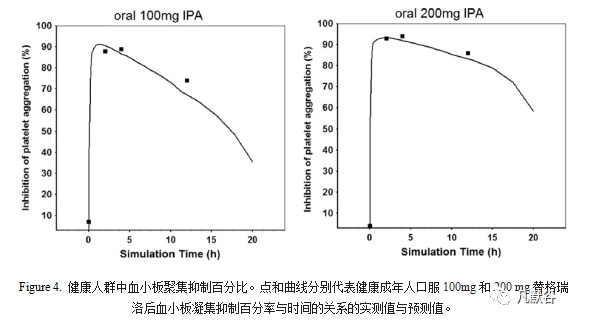
替格瑞洛一般以IPA为药效学参数,PD模型采用Sigmoid Emax模型。将替格瑞洛和其AM的总浓度用于Sigmoid Emax模型搭建,建立了药效学模型,模型估算的Emax,EC50和E0值分别为92%,75 ng/mL和3%, IPA的Hill系数为1.3。Figure 4是口服100 mg和200 mg替格瑞洛后实测和预测的PD,搭建PBPK-PD模型且具有很高的精度,变异系数(CV%)小于20%,即IPA与替格瑞洛和其AM的总血浆浓度相关,该模型可以成功地将IPA与替格瑞洛和其AM的总浓度联系起来。
3.3 肝硬化人群PBPK模型的建立和预测
在建立并验证了健康成人的替格瑞洛PBPK模型以后,在该模型的基础上纳入了肝硬化人群的生理参数,并使用已报道的CP-A人群口服单剂量90 mg替格瑞洛后血浆中替格瑞洛和其AM的PK参数进行了验证,大多数预测的药代动力学参数(AUC和Cmax)与观测值一致(<1.2倍误差),因此CP-A人群替格瑞洛PBPK模型可以反映替格瑞洛和其AM在体内的行为,结果如Table 7,Figure 5。
在CP-A人群替格瑞洛PBPK模型的基础上构建了CP-B和CP-C人群替格瑞洛PBPK模型,并预测了对应的PK参数及PK曲线,如Table 7,Figure 5.
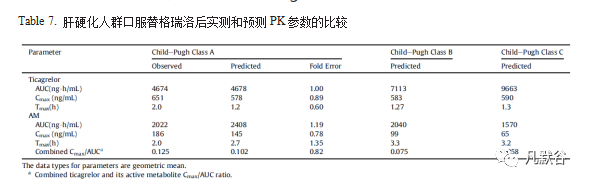
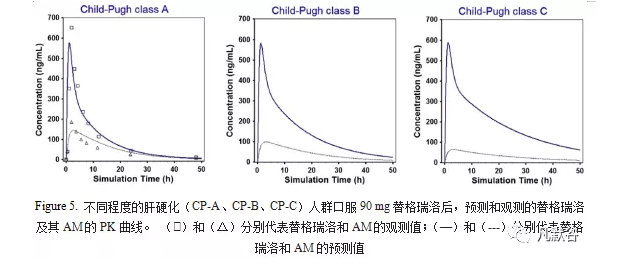
结果表明,口服90 mg替格瑞洛后的Cmax在不同程度的肝硬化(CP-A、CP-B、CP-C)人群中没有明显差异,但替格瑞洛在CP-B和CP-C人群中的AUC相比CP-A人群分别增加了52%和107%,而AM的暴露水平随疾病严重程度增加而降低(Table 7)。
3.4 肝硬化人群PD模型的建立和预测
在建立并验证了健康成年人替格瑞洛PD模型的基础上,考虑到由于使用的数据来自不同的临床研究,并且健康人群和肝硬化人群之间存在一些生理差异,因此当由从健康人群PD模型转变为肝硬化人群PD模型时,将Emax从92%优化为82%以拟合观测到的PD参数,E0,Hill系数和EC50保持恒定,结果如Figure 6左图和Table 8。
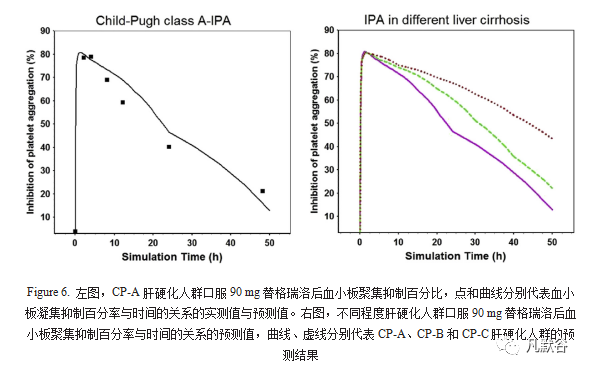
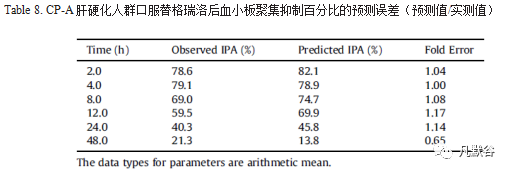
结果表明优化后的CP-A肝硬化人群PBPK-PD模型可以准确反映CP-A肝硬化人群中的药效变化,进而将该模型用于预测CP-B和CP-C肝硬化人群的IPA,结果如Figure 6右图。
已报道的研究表明IPA随着替格瑞洛和AM血浆浓度的增加而增加。与CP-A肝硬化人群相比,CP-B和CP-C肝硬化人群中预测的替格瑞洛的浓度升高,AM浓度降低,但替格瑞洛和其AM的总暴露的增加(尤其是达到Emax后),最大IPA仍保持在85%附近,因此在CP-B和CP-C肝硬化人群中的药效时间更长。
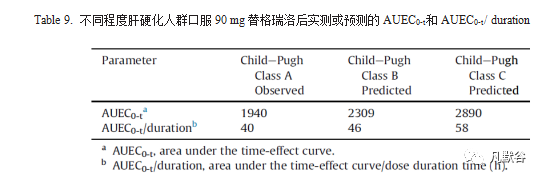
CP-B或CP-C肝硬化人群中替格瑞洛和其AM 总的Cmax / AUC低于CP-A肝硬化人群(Table 7),这表明在不同程度的肝硬化人群中药物的全身暴露存在差异。此外,如Table 9所示,当模拟相同的治疗剂量(90mg)时,预测的CP-B或CP-C肝硬化人群中IPA的平均抑制百分比(AUEC0-t / duration)与在CP-A肝硬化人群中的实测结果有所不同,CP-C肝硬化人群中预测的AUEC0-t / duration大于CP-B肝硬化人群,CP-B肝硬化人群中预测的AUEC0-t / duration大于CP-A肝硬化人群的实测值。
总体而言,基于替格瑞洛的暴露量和IPA的平均抑制百分比的变化,需要对CP-A,B和C肝硬化人群的给药剂量进行调整。
4. 讨论
这项研究首次开发了替格瑞洛及其AM的静脉和口服PBPK模型,该模型可用于预测药物的PK曲线。此外,将PD模型与PBPK模型连接起来,揭示了该药物的PD效应,即通过替格瑞洛和其AM的总浓度预测血小板聚集抑制百分比。
本研究将体外酶促动力学参数整合到PBPK模型中,成功从体外酶促动力学参数(Km,Vmax)外推获得体内代谢清除率。由于CYP3A5参与替格瑞洛的代谢比例很小,本研究没有考虑这一代谢途径。根据报道,替格瑞洛是体外P-糖蛋白(P-gp)的底物,但该药物表现为线性PK特征,这提示了P-gp在替格瑞洛代谢过程中可能不起重要作用(可能P-gp被饱和),因此本研究搭建的替格瑞洛PBPK模型没有考虑P-gp的影响。
替格瑞洛高蛋白结合率,而且主要通过肝代谢消除。因此,必须了解替格瑞洛的PK或PD行为在肝硬化病理状态中是否发生改变。替格瑞洛在CP-A肝硬化人群的Cmax被低估,原因可能是使用灌注速率受限模型时,由于疾病状态的潜在变化,无法很好地模拟达到稳态之前的分布体积;另一个原因可能是该研究中的疾病人群生理参数的变化并不能完全反映实际情况。但总体而言,预测参数在实测结果的2倍范围内,因此预测误差仍然可以接受。
不同肝硬化人群口服90mg替格瑞洛后替格瑞洛及AM的Cmax和AUC也有所不同,并在50h内伴随IPA的变化。相比CP-A肝硬化人群,CP-B和CP-C肝硬化人群口服90 mg替格瑞洛后的总暴露增加、IPA延长。
替格瑞洛通过直接与P2Y12受体结合而发挥抗血小板活性,这表明血浆是替格瑞洛的作用部位。因此,没有考察其他效应室的浓度。通过使用Sigmoid Emax药效模型,能够表征替格瑞洛对ADP诱导的血小板聚集的抑制作用。非线性浓度-药效关系的Sigmoid Emax模型以S形为特征,Hill系数表示曲线的陡度,在替格瑞洛的摄入后2小时达到了最高IPA效果,并维持了至少8小时。
本研究假设在不同人群中PK-PD关系都符合Sigmoid Emax模型。尽管PBPK和PD模型是使用不同剂量及其对应的药效建立的,但将PBPK和PD模型结合后可用于深入理解不同程度的肝硬化对替格瑞洛体内PK和PD的影响。在没有替格瑞洛在不同程度肝硬化人群中的IPA数据的情况下,建立和验证的模型表明,替格瑞洛和AM的暴露的变化会改变对血小板聚集的抑制作用,这可能需要调整剂量以避免产生不良反应。比较替格瑞洛在不同程度肝硬化人群中的PK和PD参数,提示可能需要减少替格瑞洛的剂量,但是需要更多的临床研究来确定最终的最佳剂量。
尽管本研究开发的模型可以预测PK和PD,但还有一些不足。首先,PD研究没有区分母体药物和AM的抑制作用。因此,有必要使用计算机模拟精确地解释结果并进行预测;其次,PBPK模型中部分建模数据是基于体外数据的推算和计算机的预测值,并在健康人群和CP-A肝硬化人群中验证了PBPK / PD模型。但是,由于缺少在CP-B和CP-C肝硬化人群中的PK和PD数据,在该人群中没有进行验证。将来,需要更多相关数据来验证模型;第三,使用典型受试者进行模拟,未考虑PK、PD和生理变异。但是,PK、PD和生理学的变异应包含在今后的研究中;最后,在这项研究中,仅考察了健康成年人和肝硬化人群。替格瑞洛也被广泛用于急性冠脉综合征(ACS)患者,并且ACS患者的生理参数可能存在一定差异。
5. 总结
在本研究中,证明了使用PBPK模型评估肝硬化人群PK和PD变化的价值。PBPK模型可能在抗血小板药物替格瑞洛的安全性和抗血小板策略的个体化给药中起关键作用。在未来的研究中,可将更多的潜在信息(例如转运蛋白信息)整合到PBPK模型中,以指导临床药物决策。
6.软件应用
该案例应用的软件是GastroPlus (version 9.6),涉及模块有Base, ADMET Predictor, PBPK, PKPlus, Metabolism and Transporter Module, PDPlus.
参考文献
Min Zhang a, Xiang You a, Meng Ke a, Zheng Jiao b, *, Hongwei Wu c, Pinfang Huang a, Cuihong Lin a, *; Prediction of Ticagrelor and its Active Metabolite in Liver Cirrhosis Populations Using a Physiologically Based Pharmacokinetic Model Involving Pharmacodynamics. Journal of Pharmaceutical Sciences 108 (2019) 2781-2790 IF: 3.197



 导 读
导 读