【建模文章解读】利用PBPK模型评估制剂因素对美托洛尔缓释片的BE影响
原文作者
Sumit Basu1,Haitao Yang1, Lanyan Fang2,Mario Gonzalez-Sales2, Liang Zhao2, MirjamN. Trame1, Lawrence Lesko1, Stephan Schmidt1
1 美国佛罗里达大学药学院,定量药理与系统药理学中心
2 美国FDA,仿制药办公室
解读人
陈涛,凡默谷技术部
导 读
本次解读的文章,来自FDA和佛罗里达大学的研究人员以美托洛尔作为模型药物,采用体外溶出与体内PK模型评估制剂因素对其BE的影响,并探讨影响BE的敏感参数。以考察基于机制和风险控制的策略评估仿制药替代性的可行性,以及寻找关键的质量参数保证仿制药的等效性。
案例摘要
弗罗里达大学的定量药理学与系统药理学中心与FDA仿制药办公室合作开展了一项研究课题,建立基于机制和风险的策略以形成系统性调研参比制剂与仿制药治疗不等效性的上市后报告。本研究工作中,选择美托洛尔作为模型药物,建立和验证了基于生理的药代动力学模型以系统性地考察药物以及制剂相关的性质对调试制剂的口服吸收与生物等效性的影响。研究发现控制缓释释放的聚合物性质是影响体外溶出、体内吸收与系统暴露(如药代动力学特征)的关键属性。因此,影响美托洛尔生物等效的因素主要为缓控释制剂特征,而非自身药物的性质;不同的溶出速率会导致最大血药浓度Cmax的差异,但对血药浓度-时间曲线下的面积(AUC)影响较小。
推荐理由
本工作以PBPK建模与模拟为工具,评估影响复杂口服制剂生物等效性的相关因素,并建立了完整的基于机制性模型评估仿制药等效性的一般研究策略。文章选择美托洛尔作为执行整体策略的例子,建立基于生理的吸收模型,以评估药物相关和制剂相关的因素对两个制剂生物不等效的影响。所陈述的策略还将采用其它药物(尤其是具有相同作用机理但由于药物性质的差异导致了不同释放和渗透曲线的药物)进行评估与验证,形成更具有广泛性的仿制药等效性评估策略。
软件用途
案例中,FDA和佛罗里达大学的研究人员先用GastroPlus搭建了美托洛尔静脉给药、速释口服给药后的PK模型,并利用实测的PK数据对模型进行验证;接下来建立起缓释制剂的体内外相关性,评估和筛选具有相关性的溶出条件;在此条件下,利用DDDPlus软件评估缓释制剂的释放指数及缓释成分释放速率对不同规格制剂的Cmax和AUC的影响,并进行参数敏感性分析,考察相关制剂因素对其生物等效性的影响。通过建模与模拟的技术,结果发现美托洛尔缓释成分的性质对其BE的结果有明显的影响;制剂开发过程中,需要合理控制缓释成分的释放速率,以保证制剂的生物等效。
1、研究背景
由于仿制药通过了严格的生物等效性试验(BE)测试,通常认为具有较好的安全性和有效性,因此在美国的使用也得到了快速的提升,并为美国医疗体系节省了超过了1.5万亿美元的费用。尽管制药企业和监管部门均做出了很多努力,FDA仿制药办公室还是偶尔会收到仿制药替代原研制剂时出现药效降低或不良反应提高的报告。当发生这些投诉时,FDA必须对这些现象进行彻底调查,以明确仿制药是否存在不满足批准后的质量标准;以及对仿制药无治疗效果的陈述或不良反应事件做一个合理、机制地解释。
为此,弗罗里达大学定量药理学与系统药理学中心与FDA仿制药办公室合作开展了此项研究课题,建立基于机制和风险的策略以形成系统性调研仿制药可替代性的研究报告。虽然当前这项工作关注于仿制药,但该策略方法与工作流程也同样适用于评估原研药不同处方间的等效性。该策略包括3个相互协调的部分:1) 系统药理学和生物信息学,2) 群体药代/药效(PK/PD)模型,3) 生理药代动力学(PBPK)模型。在本篇研究中,我们主要关注于第三部分的工作,即以PBPK建模与模拟为工具,评估影响复杂口服制剂生物等效性的相关因素。本篇研究通过解析药物及制剂相关的性质,也就是相应的体外溶出、药物吸收速率、系统暴露或缓控释制剂口服给药后的PK行为等,建立虚拟BE评估工作的概念框架。美托洛尔为BCSI类(高溶解、高渗透)药物,且口服速释制剂后表现出无等效性的风险,因此本工作选择了该药物作为模型化合物。但由于美托洛尔缓释制剂的不完全释放或者结肠段较慢的吸收,近年来也常报告其缓释制剂治疗不等效的现象。考虑美托洛尔具有较高的渗透性,因此制剂相关的因素是导致潜在不等效的可能原因。
2、策略与方法
2.1 评估策略
为了确定溶出的差异对药物吸收与PK的影响,本工作建立了概念性的建模与模拟工作框架,如下图1所示。首先,从简化的新药申请(ANDAs)中被证明生物等效的50及200 mg美托洛尔参比与受试缓释片剂的体外溶出曲线,以及相应的f2数据。然后,采用制剂崩解与溶出模拟软件DDDPlus评估能否回顾性地预测ANDA中所报道的2个美托洛尔仿制药缓释制剂(需结合各自的处方组成)的溶出曲线。最后,本工作逐步整合了药物相关、制剂相关以及生物系统相关(胃肠道生理学、首过代谢等)信息至GastroPlus模型中,建立和验证了美托洛尔缓释片剂基于生理的口服吸收模型。本研究使用建立和验证后的模型进行虚拟BE的评估,以探讨是否可以回顾性地预测不同处方的美托洛尔缓释制剂的BE结果(含有BE通过以及未通过的)。此外,还使用该模型预测处方性质的改变对体外溶出及BE的影响。
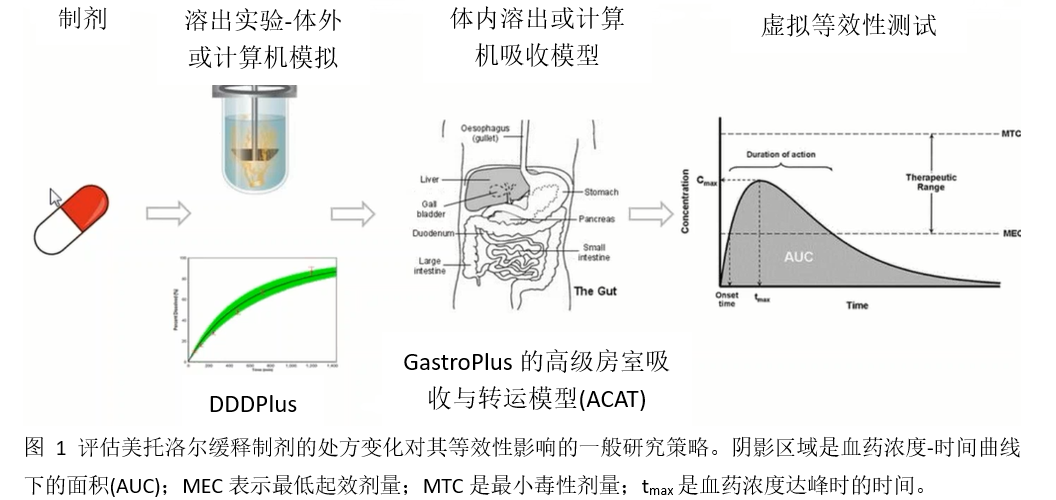
2.2 体外溶出的建模方法
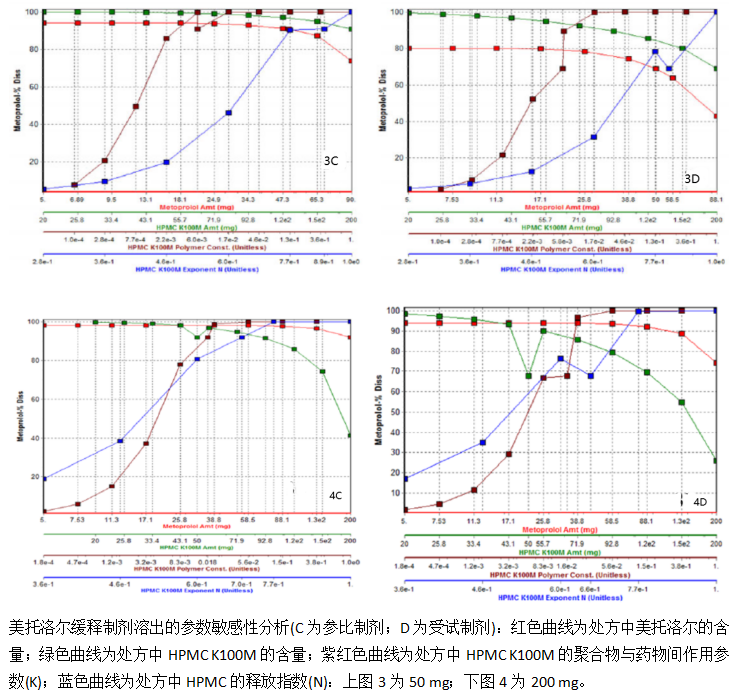
DDDPlus 4.0是由Simulations Plus公司(Lancaster, California)开发的模拟软件,并在本研究中结合制剂处方组成与规格进行体外溶出曲线的预测。该软件可以单独进行使用,也可以联合GastroPlus (version 9.0, Simulations Plus)一起使用(GastroPlus是一款PBPK建模与模拟的商业化软件)。在本研究中,使用DDDPlus软件预测了50及200 mg美托洛尔缓释仿制药(ANDA 1和2)以及参比制剂(Toprol XL®)的溶出曲线,并分别按照FDA的指导原则计算了相应的f2因子。来自25 mg美托洛尔缓释制剂(ANDA 3, 数据未显示)的数据,以及吻合ANDA 1和2中报道值与模型预测的溶出曲线、对应的f2因子等方式,建立并验证了体外溶出模型。所执行的模拟是在预先设定的条件下进行的,以反映实际溶出实验的条件(n=12, 采用USP II法, pH 6.8的500 mL磷酸盐介质,搅拌桨转速为50 rpm,温度为37±0.5℃)。由于在ANDA文件中,受试制剂精确的处方组成信息较为有限,因此在模型中假设受试与参比制剂处方中所用的辅料名称是相同的;由于不同的工艺条件,它们实际的用量与性能会有所差异。此外,在DDDPlus中执行了参数敏感性分析以及虚拟BE考察,以鉴定显著影响美托洛尔缓释片剂体外溶出的活性药物成分(API)及制剂性质。由于美托洛尔缓释片剂的的溶出是通过羟丙基甲基纤维素(HPMC)进行控制的,因此聚合物相关机制(扩散及溶蚀)的固有特性以及API从聚合物基质中的释放速率也需要做特别的考虑。此处的释放速率主要取决于聚合物的弯曲强度以及孔隙率,释放机制主要取决于聚合物的类型、级别以及分子量。DDDPlus软件表征聚合物基质的形成与分解的公式来自Korsmeyer等人提出的理论。在这个公式中,API从缓释制剂中的释放取决于两个参数:N和K。其中,N也称为释放指数,是用于洞悉API释放的主要机制(API从基质中扩散还是聚合物的溶蚀)。如果N等于0.5时,则API的释放则是扩散驱动的;而如果N大于0.5,API释放则取决于聚合物基质的溶蚀。K则是表征API从聚合物基质中释放速率的常数。其它影响药物释放速率与释放机制的参数,连同N和K一起以模型公式的形式展现在了补充材料中。
2.3 口服吸收模型的建模方法
考虑到缓释制剂的仿制药与参比药之间不等效的原因是胃肠道内溶出和吸收的差异,而不是分布体积与系统清除的差异,因此本研究采用了GastroPlus软件的高级房室吸收与转运(ACAT)模型建立并外部验证了美托洛尔缓释制剂的生理吸收模型;采用PKPlus模块分析计算血药浓度-时间数据点,并获取得主要的PK参数以作为经典房室处置模型的数据。
2.4 建模数据及流程
美托洛尔体内PK以及体外溶出模型搭建过程中,所输入的药物的基本理化性质参数、药物血浆清除与分布相关的参数等列举于下表所示。
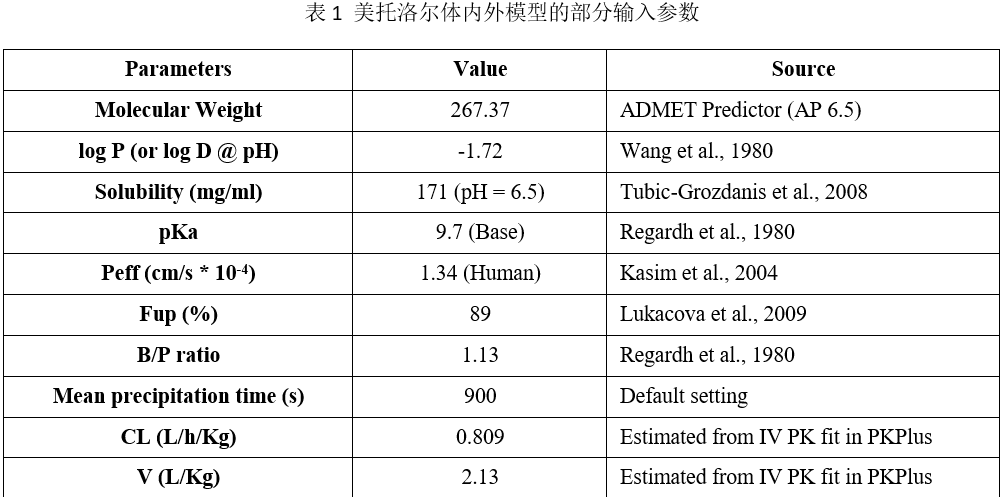
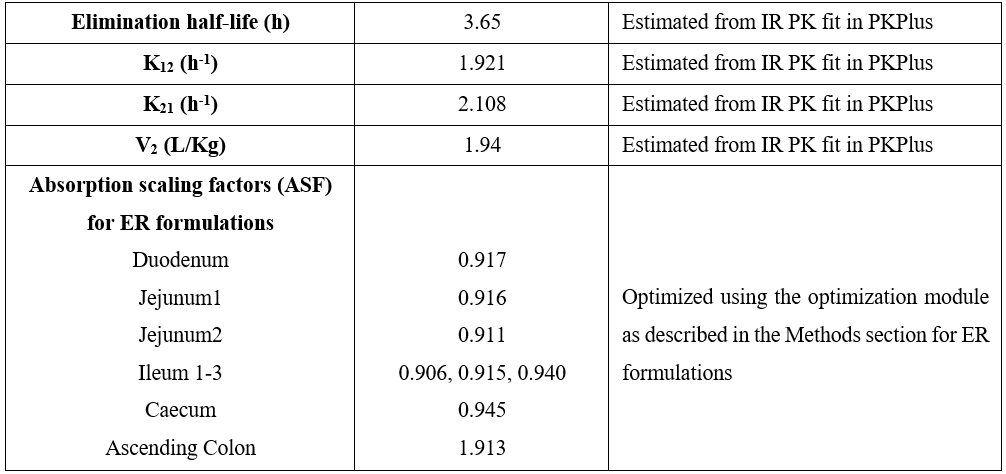
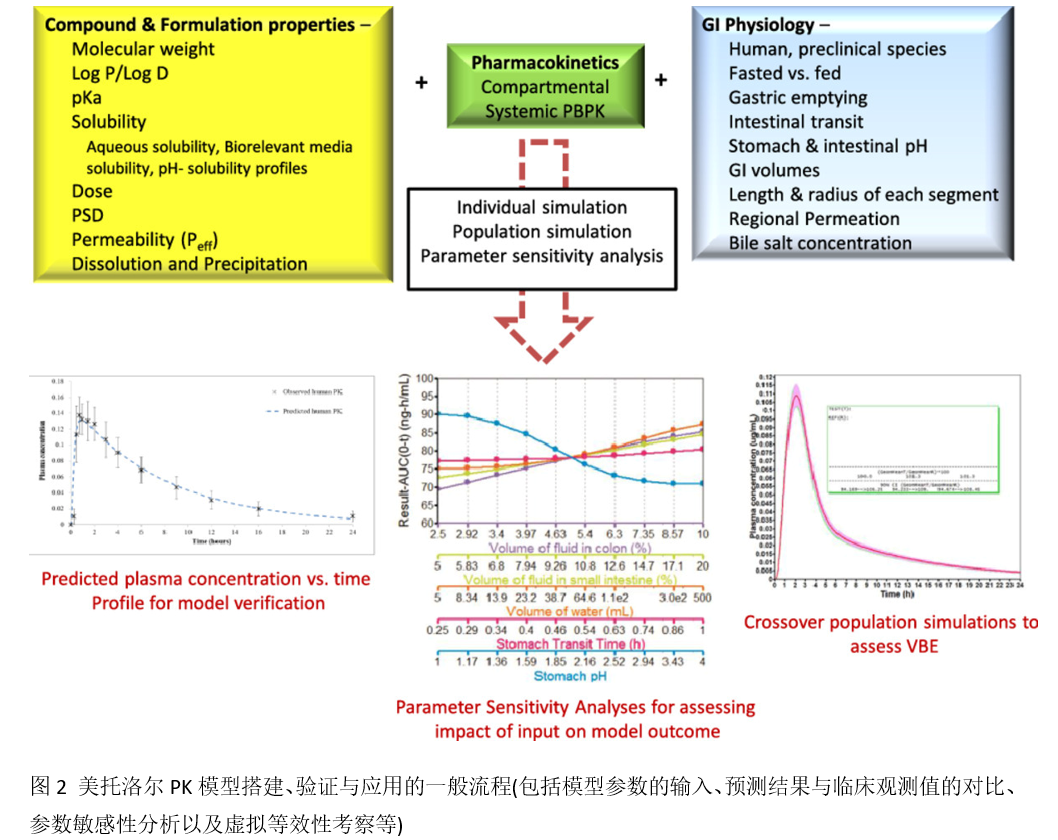
在获得上述模型参数后,将药物相关的参数、机体生理参数一起整合至机制性口服吸收模型中,并预测和验证美托洛尔在人体内的PK特征。验证后的模型可以执行参数敏感性分析考察影响药物体内吸收的关键参数,以及通过交叉群体模拟评估仿制药与参比制剂生物等效的可能性。具体的建模与模型应用流程如下图所示。
3、模型结果与分析
模型首先结合制剂组成的相关信息,评估DDDPlus的分析结果能否回顾性地反映美托洛尔参比与仿制缓释制剂的体外溶出曲线,并进一步研究发现影响美托洛尔的体外溶出的主要因素。然后将体外溶出的发现转换至评估体内BE情况,本工作将美托洛尔缓释制剂的体外溶出曲线加载至PBPK模型中,以便更深入的评估考察。PBPK模型是逐步建立起来的:首先,评估发现采用2房室模型是表征静脉给药美托洛尔的血药浓度-时间曲线的最合适模型;再考虑肠道的渗透以及肝脏的首过代谢(48%),表征空腹状态下口服美托洛尔速释片剂的PK曲线;进一步联合相应的体外溶出曲线,考察所建立的模型是否可以表征缓释制剂给药后的PK行为。
3.1 体外溶出模型的建立和确认
采用DDDPlus软件回顾性地反映美托洛尔参比与仿制缓释制剂的体外溶出曲线:图3为50 mg (ANDA 1)的结果(3A-参比制剂;3B-仿制药);图4为200 mg (ANDA 2)的结果(4A-参比制剂;4B-仿制药)。经计算比对,ANDA相应报道的以及DDDPlus计算的f2数值可以很好地保持一致。
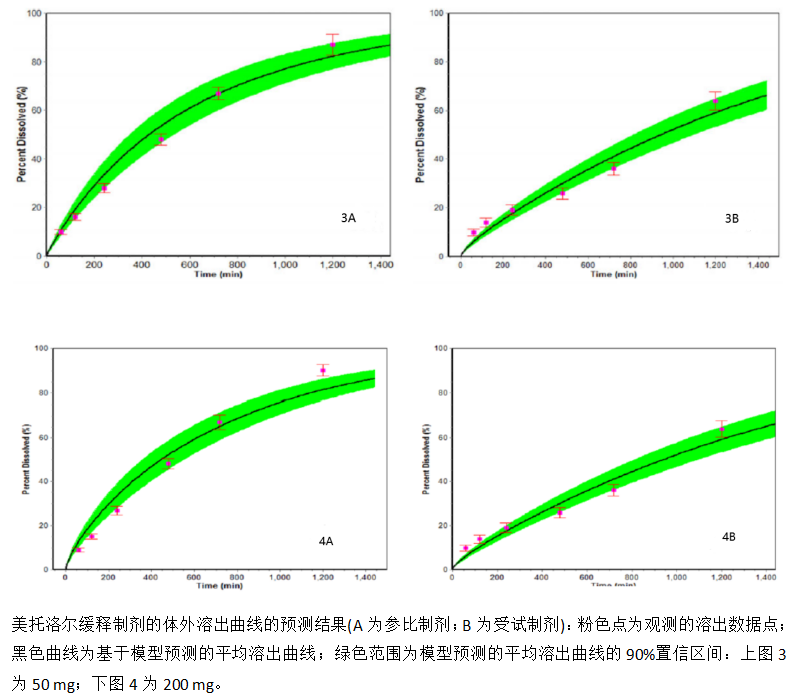
本研究还进一步发现了美托洛尔的体外溶出主要受控释聚合物HPMC的性能影响(图3和4)。
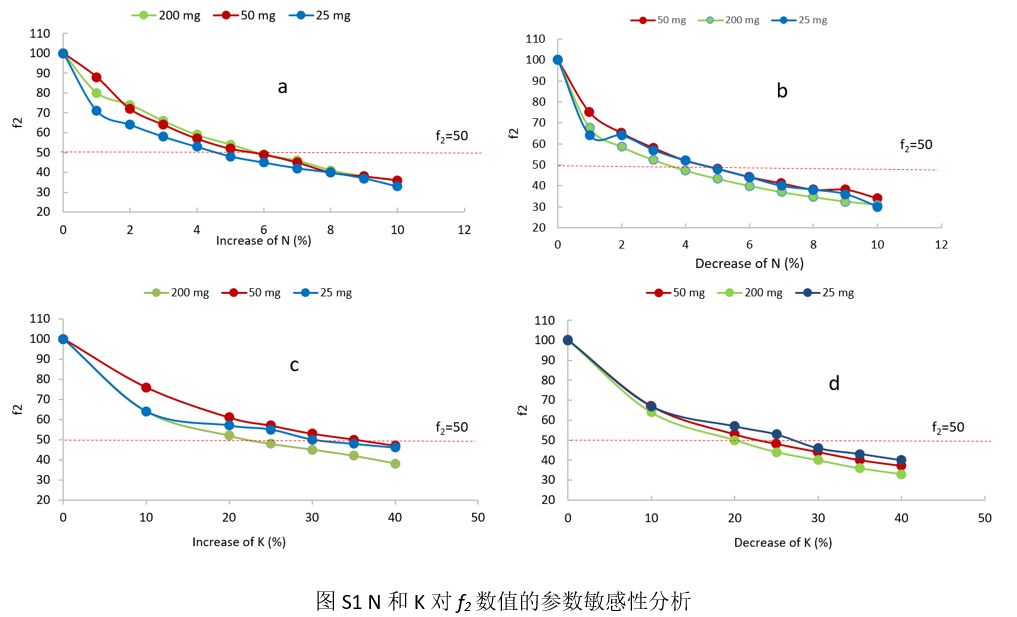
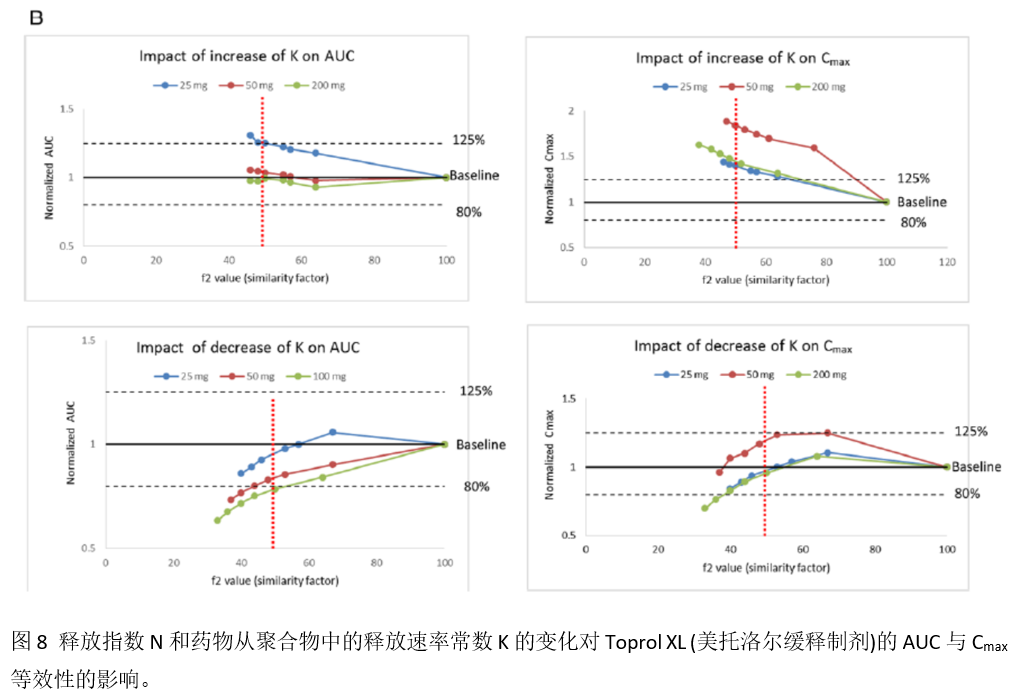
图S1发现,聚合物的类型、级别、分子量等即使发生相对微小的变动,也会敏感影响到美托洛尔缓释制剂的溶出特点。根据模拟的结果,发现N平均升高约6% (图S1a)或降低约5% (图S1b)时,都会造成f2失败;相比之下,K需要平均增大(图S1c)或降低(图S1d)约25% 才会导致f2失败。
3.2 静脉给药PK模型的建立和验证
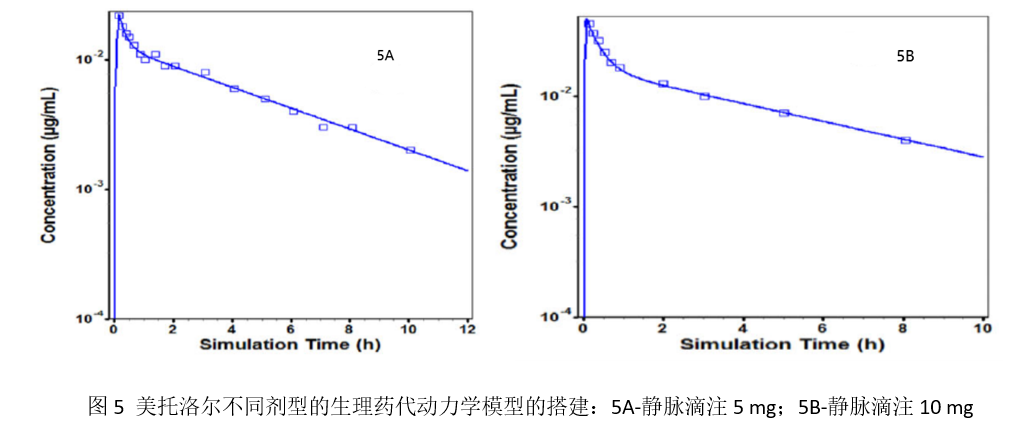
为了表征美托洛尔静脉滴注(5 mg, T=10 min; 10 mg, T=5 min)给药后的血药浓度-时间曲线,本研究使用Regradh等人此前报道的平均浓度-时间数据,通过PKPlus模块测试了不同的模型结构(1, 2, 3房室)的预测表现;最佳的房室模型根据赤池信息准则(AIC)进行确定。首先搭建了5 mg给药后的模型,然后通过同一篇文献中的10 mg给药后的预测曲线与实际观测值之间的吻合程度,对初始建立的模型进行验证。评估发现采用2房室模型是表征静脉给药美托洛尔的血药浓度-时间曲线的最合适模型,其中图5A为5 mg的模型(1房室的AIC为-57.26;2房室为-90.43;3房室为-86.43);图5B是10 mg的模型(1房室的AIC为-23.84;2房室为-65.145;3房室为-61.7)。
3.3 速释口服给药模型的建立和验证
当建立并验证了静脉滴注给药模型后,采用ACAT模型考虑吸收与系统循环前的首过代谢(48%),以将静脉模型拓展至对口服吸收的预测。为了区分药物相关以及制剂相关的因素对吸收和PK的影响,模型先搭建了空腹状态下50 mg速释片剂给药后的吸收模型。将表1中列举的粒径分布、理化性质(溶解度、pKa、扩散系数、logP以及渗透性)、PK模型参数等模型输入数据。所建立的50 mg速释片剂的模型进一步拓展至100 mg的速释模型,并通过对比预测曲线与相同剂量下的观测数据间的吻合程度,对建立的速释模型进行了验证。图5C和5D分别为空腹状态下口服50 mg和100 mg美托洛尔速释片剂的PK曲线,所统计的主要PK参数也表明预测的AUC和Cmax与观测值可以很好地吻合。
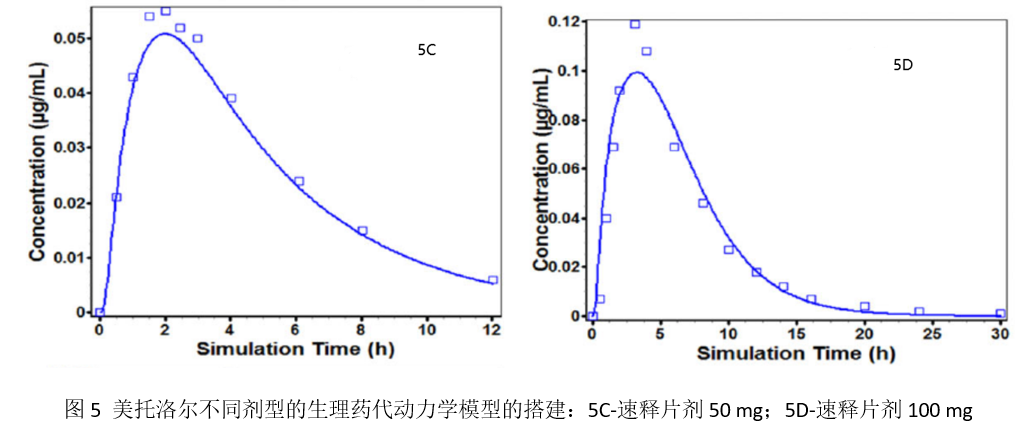
3.4 缓释制剂吸收模型的建立和验证
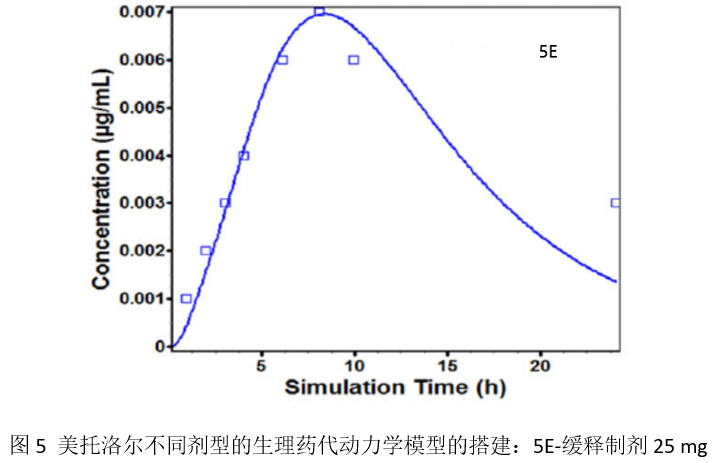
由于缓释制剂中的美托洛尔不是立即吸收,而是随着药物从聚合物基质中释放出来逐渐吸收。为了确定美托洛尔在肠道下端(盲肠与升结肠)的最大吸收能力,模型中设定了近端盲肠段的转运时间为0.0001小时。ACAT模型中通过吸收放大因子(ASF,是一个混合参数,综合了表面积/体积比、pH效应、摄取/外排转运、细胞旁路吸收以及其它限制每个肠段吸收的因素)表征药物的最大吸收能力。采用软件的优化模块并设定1/^Y2的权重,通过Hooke和Jeeves模式搜索法优化了盲肠和升结肠各自的ASF数值。当回归系数(R2)大于0.9时(该阈值经常见于文献报道),认为成功完成了参数的优化。最后通过文献报道的6个健康受试者结肠内约给予90 mg美托洛尔(灌注速率约4.5 mL/min,持续150分钟)的PK观测结果,对基于模型的预测结果进行了外部验证。当整个肠段的ASF数值确定后,进一步联合深入研究的参比制剂体外溶出曲线,建立和验证25 mg Toprol-XL®的缓释吸收模型和完整的PK行为(见图5E)。
本工作还发现速释制剂口服给药后的主要吸收部位是小肠的上段(十二指肠-21%,回肠-16%至36%);Toprol-XL®(25 mg, 图6B)主要的吸收部位下移至胃肠道的下段(盲肠-20%,升结肠-38%)。
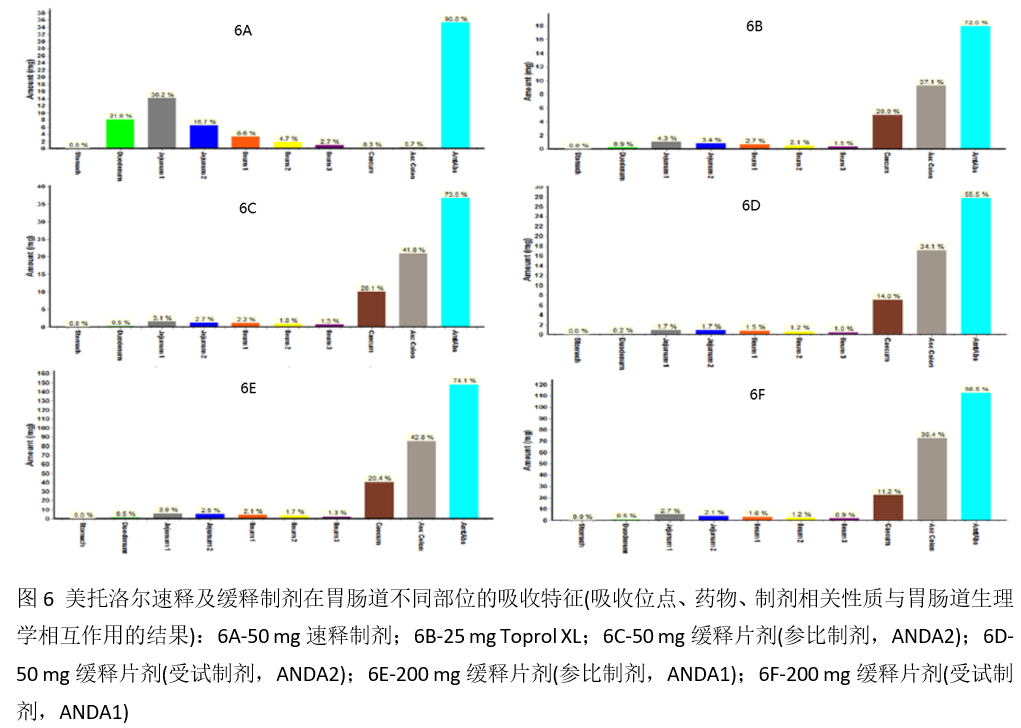
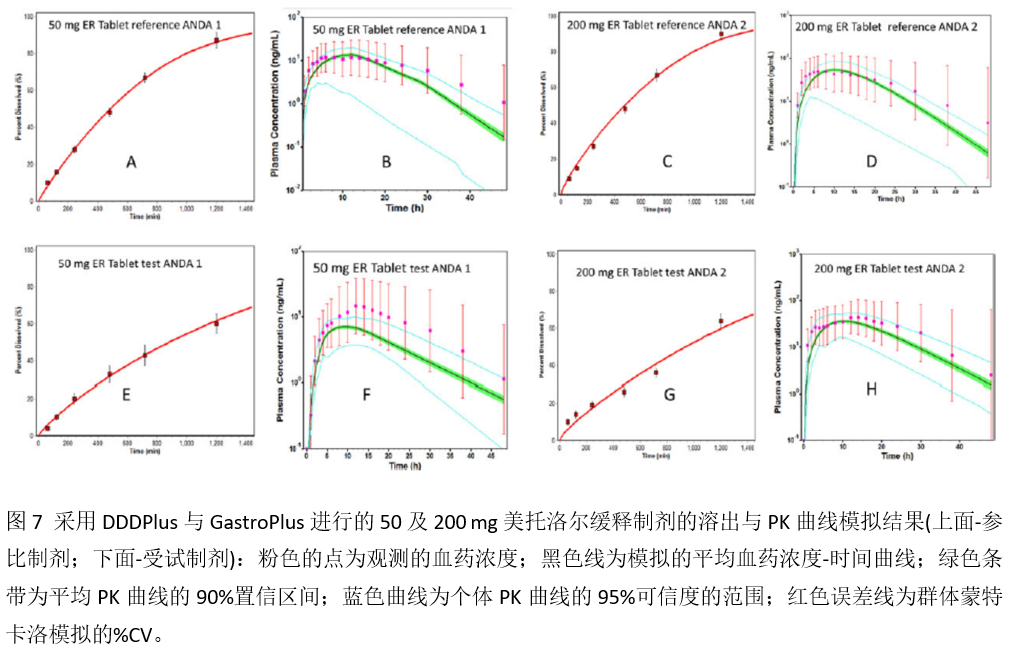
和25 mg Toprol-XL®模型相似,50 mg以及200 mg Toprol-XL®的PK曲线也可以较合理地预测(图7)。研究还发现高剂量的Toprol-XL®吸收部位也与低剂量25 mg相似,主要发生在胃肠道的下段(20%至40%的吸收)。然而,两个受试制剂(ANDA 1和2)在结肠吸收的总量要低于参比制剂的结肠吸收量(图6),这可能是最终导致受试制剂相对参比制剂的相对口服生物利用度降低的根本原因(ANDA 1:参比-73.5%,受试-55.5%;ANDA 2: 参比-74.1%,受试-56.5%)。
3.5 参数敏感性分析
由于除了输入每个制剂对应的溶出曲线,模型中的其它参数都保持一致,因此各个模型的差异主要来自美托洛尔从缓释制剂中的释放速率与程度的差异,以及由此引起的吸收差异。本研究进行了单个参数的敏感性分析,以分析在空腹状态下主要影响Toprol-XL®吸收与PK的参数。特别考虑了药物相关的性质参数(如粒径、粒子密度和溶解度)和制剂相关的参数(如N和K)。当系统性地评估制剂相关因素的变化对BE的影响时,研究发现相对于AUC,Cmax受N和K的变化更为敏感。当N增大超过1%时,就会导致Cmax的不等效;而结果显示N增大超过3%时,才会导致25 mg Toprol-XL®的AUC出现不等效的结果。与之对应的,N需降低超过9%时,才会导致Cmax和AUC的不等效。而K变化的影响相对要小一些:当K上升超过30%或下降20%时,才会导致AUC的不等效;不过对Cmax来说情况会稍复杂一些:尽管K的下降看上去对Cmax的影响较小,但不高于10%的上升时会引起该参数的显著变化。尽管基于f2的体外溶出标准,在大多数情况下可以较合适地表征释放机制(N)和释放速率(K)对AUC和Cmax的影响,但结果还是发现它们未能完全反映释放速率的增大对Cmax的影响。
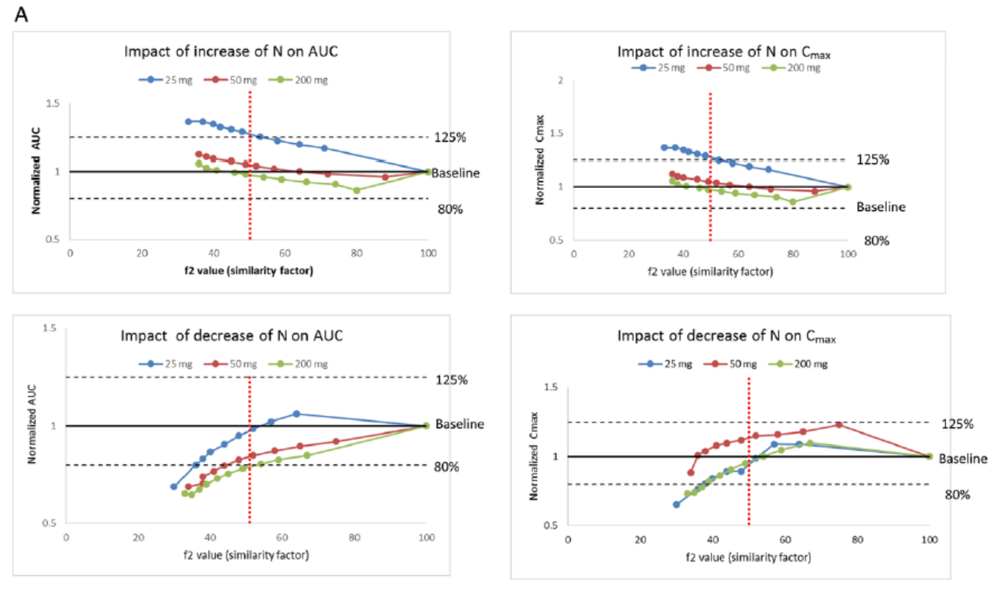
3.6 健康受试者的BE模拟
最后,本研究进行了健康受试者的虚拟BE分析,结合制剂的体外溶出曲线以及AUC和Cmax相对应的90%置信区间,以确认是否可以重现已有的两个临床BE试验结果(这两个临床试验分别是美托洛尔缓释仿制药ANDA1和2与参比制剂Toprol-XL®的对比)。在空腹状态下,对受试制剂与参比制剂两个规格(50 mg与200 mg)开展了临床模拟。基于模型预测的血药浓度-时间曲线能够与来自62个受试者给药50 mg美托洛尔缓释片剂(ANDA 1)和33个受试者给药200 mg美托洛尔缓释片剂(ANDA 2)的观测结果吻合,说明当前的研究模型具有较高的准确性。
4、模型讨论
本研究采用DDDPlus软件考察能否回顾性地重现2个美托洛尔仿制药(ANDA 1和ANDA 2)以及参比制剂(Toprol-XL®)的溶出曲线。模拟结果发现所预测的溶出曲线(根据处方组成、剂量等信息通过DDDPlus预测得到)和实验测定的结果较好地吻合;敏感性分析结果提示控释释放的聚合物HPMC的性质将非常敏感地影响制剂的溶出。口服给药后,HPMC迅速形成凝胶层,并随之作为美托洛尔的扩散屏幕、决定药物从制剂中释放出来的速度以及成为可吸收的部分。通常,API从聚合物中的释放受到聚合物基质的扩散或分解的速度驱动;经溶出建模发现N大于0.5,提示美托洛尔的释放受HPMC基质的溶蚀特性控制。N是一个混合参量,汇总了影响药物释放机制的相关因素,如聚合物的类型、级别和分子量等。尽管通过敏感性分析发现N的变化将非常敏感地影响制剂的溶出和BE,但在良好控制的工艺条件下,这些影响因素应当可以被重复出来的。这导致考察第二个影响因素,也即药物的释放速率K:相关的参数包括了孔隙率和弯曲强度,主要受工艺过程的影响。分析结果进一步提示了f2因子的限值设置为50,对于预测体外溶出曲线的相似性是较为合适的,但是不能全部转换至体内BE结果(图8B显示了溶出速率K增大对BE的影响)。值得注意的是当前分析的结果受限于ANDA文件中未展示的美托洛尔缓释制剂的具体处方组成,导致研究不能详细分析处方中辅料、工艺条件等对BE的影响。基于模型研究发现美托洛尔缓释制剂等效的情况与控释释放的聚合物性质更为相关,而非API的性质;特别是药物从聚合物基质中释放的相关性质(如孔隙率或弯曲强度),将决定了药物溶出、吸收、PK性质的相似性(BE评估的前提假设是不同制剂间的释放机制是相同的)。评估结果也建议对于复杂制剂(如美托洛尔这种缓释制剂)的BE评估,应当合适地测定AUC与Cmax这些PK参数,因为这些参数对于不同的药物、剂型等性质差异较为敏感。当前概述的策略也可将评估健康人BE考察结果转至特定疾病人群的BE情况,如器官损伤或胃肠道疾病的人群、儿童或老年人、或者其它情形的病人(如疾病伴随着胃肠道生理学改变的人群)。PBPK模型在解决这些问题方面具有独特的优势,因为该模型可以整合不同的人群和制剂特征至虚拟BE试验中。当参比制剂转为仿制药时,美托洛尔Cmax的改变可能会引起血压、心率等变化,理论上会引起各种不良反应,如头晕、恶心或心悸等。当前的生理吸收模型可以作为一个理想的平台,并进一步链接美托洛尔缓释制剂的PK/PD模型,以鉴定BE的变化是否会导致治疗不等效的风险,从而引起药效的降低或不良反应的升高。
5、总结
当前研究选择了具有不同缓释制剂治疗不等效结果的美托洛尔作为模型药物,经对比速释制剂与缓释制剂的口服吸收特点,发现美托洛尔的吸收速率和程度主要取决于其从缓释制剂中的释放速率和机制。因此美托洛尔可以区分药物相关(对速释制剂较重要)和制剂相关(对于缓释制剂影响明显)的因素对口服缓释制剂后生物等效的影响,如仿制药与参比制剂,或开发中的制剂与即将上市的制剂。所陈述的策略在随后还将用于评估其它的药物,以确定当前对于美托洛尔的研究结论是否具有更广泛的应用,尤其会将关注于具有相同作用机理但由于药物性质的差异导致了不同释放和渗透曲线的药物。总之,当前所使用的策略有望用于评估BE或者不等效所引起的潜在风险,不过还需要开展更多的工作以更有信心地在执行体内试验之前预测BE的可能性。本研究的原始问题是希望找到导致所报道的仿制药与参比制剂生物不等效的可能原因;当然这项研究也可以用于其它的BE研究场景,如比较关键临床试验中所使用的制剂与即将上市制剂间(相比关键临床试验时,制剂发生了一些变化)的等效性情况。
6、应用软件
该案例应用的软件是GastroPlus (version 9.0),涉及模块有Base, Optimization, PKPlus;以及DDDPlus (version 4.0);和ADMET Predictor (version 6.5)。
参考文献
Sumit Basu, Haitao Yang, Lanyan Fang, et al., Physiologically Based Pharmacokinetic Modeling to Evaluate Formulation Factors Influencing Bioequivalence of Metoprolol Extended-Release Products. J Clin Pharmacol. 2019 Sep; 59 (9): 1252-1263. IF=2.425


